
【题目】甲醇既是重要的化工原料,又可作为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主要反应如下:
①CO(g)+2H2(g)![]() CH3OH(g) ΔH1
CH3OH(g) ΔH1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH2
CH3OH(g)+H2O(g) ΔH2
③CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH3
CO(g)+H2O(g) ΔH3
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:
化学键 | H-H | C-O | C≡O | H-O | C-H |
E/( kJmol-1) | 436 | 343 | 1076 | 465 | 413 |
由此计算ΔH1=______。已知ΔH2=-58 kJmol-1,则ΔH3=______。
已知:CO中的化学键是C≡O,CH3OH的结构式为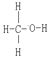 。
。
(2)已知下列热化学方程式:
①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ΔH1=―870.3 kJ·mol-1;
②C(s)+O2(g)=CO2(g) ΔH2=―393.5 kJ·mol-1;
③H2(g)+1/2O2(g)=H2O(l) ΔH3=―285.8 kJ·mol-1。
则反应2C(s)+2H2(g)+O2(g)=CH3COOH(l)的ΔH=______kJ·mol-1。
(3)中国科学院长春应用化学研究所在甲醇(CH3OH)燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆。甲醇燃料电池的工作原理如图所示。
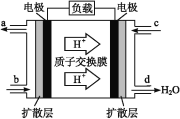
①该电池工作时,b口通入的物质为___。
②该电池正极的电极反应式为______________。
③工作一段时间后,当12.8 g甲醇完全反应生成CO2时,有____NA个电子转移。
【答案】-99 +41-488.3CH3OHO2+4H++4e-=2H2O2.4
【解析】
(1)反应热等于断键吸收的能量与形成化学键所放出的能量的差值,则根据表中数据和反应的化学方程式CO(g)+2H2(g)![]() CH3OH(g)可知反应热△H1=1076 kJ/mol+2×436 kJ/mol-3×413 kJ/mol-343 kJ/mol-465 kJ/mol=-99kJ·mol-1。根据盖斯定律可知②-①即可得到反应③,则△H3=-58 kJ/mol+99 kJ/mol=+41kJ·mol-1。
CH3OH(g)可知反应热△H1=1076 kJ/mol+2×436 kJ/mol-3×413 kJ/mol-343 kJ/mol-465 kJ/mol=-99kJ·mol-1。根据盖斯定律可知②-①即可得到反应③,则△H3=-58 kJ/mol+99 kJ/mol=+41kJ·mol-1。
(2)已知:
①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ΔH1=―870.3 kJ·mol-1;
②C(s)+O2(g)=CO2(g) ΔH2=―393.5 kJ·mol-1;
③H2(g)+1/2O2(g)=H2O(l) ΔH3=―285.8 kJ·mol-1。
则根据盖斯定律可知②×2+③×2-①即得到反应2C(s)+2H2(g)+O2(g)=CH3COOH(l)的ΔH=-488.3 kJ·mol-1。
(3)①氢离子向右侧电极移动,则右侧电极是正极,左侧电极是负极,发生失去电子的氧化反应,所以该电池工作时,b口通入的物质为CH3OH。
②负极甲醇失去电子,正极氧气得到电子,由于存在质子交换膜,因此该电池正极的电极反应式为O2+4H++4e-=2H2O。
③甲醇中碳原子化合价从-2价升高到+4价,失去6个电子。12.8 g甲醇的物质的量是12.8g÷32g/mol=0.4mol,所以完全反应生成CO2时,有2.4NA个电子转移。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】短周期主族元素A、B、C、D 原子序数依次增大且最外层电子数之和为17。B、D 同主族,短周期中C原子半径最大,B最外层电子数是次外层的3倍。下列推断不正确的是
A. 元素B、C、D 形成的化合物的水溶液呈中性
B. 元素B、C 形成的化合物中可能既含有离子键又含共价键
C. 离子半径从大到小的顺序为D>B>C
D. 元素B 的简单气态氢化物的热稳定性比D 的强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在用Zn片、Cu片和稀硫酸组成的电池装置中,经过一段时间工作后,下列说法中正确的是
A. 锌片是正极,铜片上有气泡产生
B. 电流方向是从锌片流向铜片
C. 溶液中的阳离子向正极移动,阴离子向负极移动
D. 电解液的PH值逐渐减少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】东晋《华阳国志南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外, 曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)镍元素基态原子的电子排布式为_____。
(2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4 蓝色溶液。
① [Ni(NH3)6]SO4中 H、N、O 元素的电负性由大到小的顺序为_____;SO42-的立体构型是_________;与 SO42-互为等电子体的微粒为_____(填化学式,任写一种)。
② 氨的沸点高于膦(PH3),原因是______; 氨是_____分子(填“极性”或“非极性”),中心原子的轨道杂化类型为 。
(3)元素铜与镍的第二电离能分别为:ICu=1959kJ/mol ,INi=1753kJ/mol ,第二电离 ICu>INi 的原因是____________。
(4)铜的某种氯化物不仅易溶于水,而且易溶于乙醇和丙酮,其链状结构如图所示,则该氯化物的 化学式为____________________,属于_____晶体。

(5)Cu2+与乙二胺可形成上右图所示配离子,其中所含化学键类型有 ____(填标号)。
a.配位键 b.极性键 c.离子键 d.非极性键 e.金属键
(6)某镍白铜合金的立方晶胞结构如图所示。晶胞中铜原子与镍原子的数量比为_____。
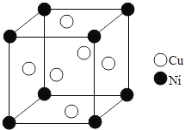
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列几组物质:
①35Cl和37Cl;②石墨与C60;③CH4和CH3CH2CH3;④![]() 和
和![]() ;
;
⑤CH3CH=CH2和CH2=CH—CH=CH2;⑥(CH3)2CHCH3和![]() ;⑦
;⑦ 和
和 。
。
(1)互为同位素的是___________________(填序号,下同)。
(2)互为同分异构体的是__________________。
(3)互为同系物的是_______________________。
(4)互为同素异形体的是_________________________。
(5)属于同一种物质的是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA 为阿伏加德罗常数的值。下列说法正确的是
A. 1 L 1 mol·L-1的NaHCO3 溶液中含有HCO3-的数目为NA
B. 78 g 苯含有C=C 双键的数目为3NA
C. 常温常压下,6. 72 L NO2与水充分反应转移的电子数目为0. 1NA
D. 冰醋酸和葡萄糖的混合物30g含有碳原子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列反应框图填空。已知反应①是工业上生产化合物D的反应,反应⑤是实验室鉴定化合物E的反应(E能引起温室效应)。
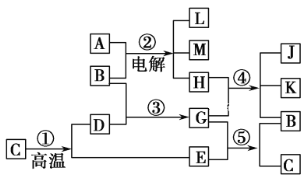
(1)单质L是________;化合物A是________。
(2)图中除反应①以外,还有两个用于工业生产的反应,是________和________(填代号)。它们反应的化学方程式分别是:____________________和_____________________。
(3)E和K、J混合溶液反应的化学方程式为_______________________________。此反应的发生说明了___________________________________________________________。
(4)把K、J混合固体放入少量浓盐酸中,则其反应的现象是____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com