
【题目】已知硫氰[(SCN)2]为拟卤素,其分子及阴离子的性质与卤素性质相似。将硫氰化钾溶液与氯化铁溶液混合,溶液变为红色。完成下列填空:
(1)写出该反应的化学方程式:__。
(2)将生成的红色溶液分为三等份,进行如下实验(第三份是对照):
①第一份中加入碘化钾溶液至过量,再加入四氯化碳,充分振荡,最终水层接近无色,四氯化碳层呈___色,写出该过程的离子方程式:__。向该溶液中滴加少量溴水,水溶液又变为红色,则氧化性Br2___(SCN)2(填“大于”、“小于”或“无法确定”)。
②第二份中加入少量酸性高锰酸钾溶液,红色褪去。完成并配平该反应的离子方程式。若含___mol高锰酸钾的溶液完全反应,转移电子2mol。
__+_+__→__+__(SCN)2+__
【答案】FeCl3+3KSCN![]() Fe(SCN)3+3KCl 紫红 2Fe3++2I-=2Fe2++I2 无法确定 0.4; 2MnO4-;10SCN-;16H+;2Mn2+;5;8H2O
Fe(SCN)3+3KCl 紫红 2Fe3++2I-=2Fe2++I2 无法确定 0.4; 2MnO4-;10SCN-;16H+;2Mn2+;5;8H2O
【解析】
(1)硫氰化钾溶液与氯化铁溶液反应生成Fe(SCN)3;
(2)①三价铁离子能将碘离子氧化为碘单质;溴单质氧化性大于二价铁离子;
②反应物是高锰酸根、氢离子和硫氰根,生成物是锰离子和(SCN)2;根据方程式中转移的电子数计算反应的高锰酸钾。
(1)硫氰化钾溶液与氯化铁溶液反应生成Fe(SCN)3,反应的化学方程式FeCl3+3KSCN![]() Fe(SCN)3+3KCl;
Fe(SCN)3+3KCl;
(2)①三价铁离子能将碘离子氧化为碘单质,四氯化碳能萃取碘水中的碘,四氯化碳层呈紫色,该过程的离子方程式2Fe3++2I-=2Fe2++I2;溴单质氧化性大于二价铁离子,能将二价铁离子氧化为三价铁离子,无法确定溴单质和(SCN)2的氧化性强弱;
②Mn元素化合价从+7价降低到+2价,得到5个电子,N元素化合价从-3价升高到—2价,失去1个电子,则该反应的离子方程式2MnO4-+10SCN-+16H+=2Mn2++5(SCN)2+8H2O;故转移电子2mol,有0.4mol高锰酸钾反应。


 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏加罗常数的值,下列说法正确的是( )
A.标准状况下,22.4 L H2O中含有氢原子数目为2NA
B.17 g NH3所含质子数为10NA
C.0.1 mol Cu(NO3)2中含有的离子数目为0.2NA
D.28 g N2体积为22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.铁和硫酸铜溶液的反应:2Fe+Cu2+=2Fe3++Cu
B.在硫酸溶液中加入氢氧化钠溶液:H++OH-=H2O
C.硫酸铜溶液与氢氧化钡溶液反应:SO42-+Ba2+=BaSO4↓
D.向沸水中滴加氯化铁饱和溶液制备Fe(OH)3胶体:Fe3++3H2O![]() Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有mg某气体,它由双原子分子构成,它的摩尔质量为Mg·mol-1。若阿伏加德罗常数的值用NA表示,则:
(1)该气体的物质的量为___mol。
(2)该气体所含原子总数为___个。
(3)该气体在标准状况下的体积为___L。
(4)该气体一个分子的质量为___g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】多种短周期非金属元素的气态氧化物常会造成一些环境污染问题,化学工作者设计出将工业废气中污染物再利用的方案,以消除这些不利影响。
(1)以NH3、CO2为原料生产重要的高效氮肥——尿素[CO(NH2)2],两步反应的能量变化示意图如下:
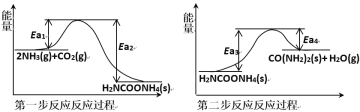
写出以氨气和二氧化碳气体为原料合成尿素的热化学方程式_________,已知两步反应中第二步反应是生产尿素的决速步骤,可判断Ea1_____Ea3(填“>”、“<”或“=”)。
(2)向体积为2 L的恒温恒容容器中通入2 mol CO和2 mol SO2,发生反应2CO(g)+SO2(g)![]() 2CO2(g)+S(s)。若反应进行到10 min时达平衡,测得CO2的体积分数为0.5,则前16 min的平均反应速率v(CO)=____,该温度下反应化学平衡常数K=____。
2CO2(g)+S(s)。若反应进行到10 min时达平衡,测得CO2的体积分数为0.5,则前16 min的平均反应速率v(CO)=____,该温度下反应化学平衡常数K=____。
(3)利用“亚硫酸盐法”吸收工业废气中的SO2。

①室温条件下,将工业废气通入(NH4)2SO3溶液中,测得溶液pH与含硫组分物质的量分数的变化关系如图所示,b点溶液中n(![]() )∶n(
)∶n(![]() )=________。
)=________。
②已知室温条件下,Ka1(H2SO3) =1.5×10-2;Ka2(H2SO3) =1.0×10-7;Kb(NH3H2O) =1.8×10-5。室温下,0.1molL-1的(NH4)2SO3溶液中离子浓度(不考虑OH-)由大到小顺序为________。
(4)利用电解烧碱和食盐的混合液,使工业废气脱氮,原理如图。
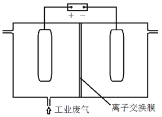
①NO被阳极产生的氧化性物质氧化为![]() 反应的离子方程式:_________________。
反应的离子方程式:_________________。
②为使该电解装置能较长时间正常工作,保持两极电解质溶液导电能力相对稳定,该装置中应使用_______ 离子交换膜(填“阴”或“阳”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯酚和丙酮都是重要的化工原料,工业上可用异丙苯氧化法生产苯酚和丙酮,其反应和工艺流程示意图如下,下列有关说法正确的是( )
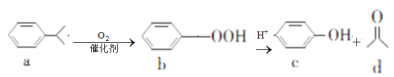
A.a、b、c均属于芳香烃B.a、d中所有碳原子均处于同一平面上
C.a有9种属于芳香族的同分异构体D.c、d均能发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关甲、乙、丙、丁四个图示的叙述不正确的是( )
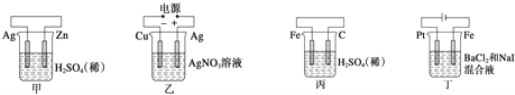
A.甲中负极反应式为![]()
B.乙中阳极反应式为![]()
C.丙中![]() 向碳棒方向移动
向碳棒方向移动
D.丁中电解开始时阳极产生黄绿色气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图的各方框表示一种反应物或生成物(某些物质已经略去),其中常温下A、C、D为无色气体,C能使湿润的红色石蕊试纸变蓝。

(1)写出物质X的化学式:__。
(2)写出下列变化的化学方程式:
①A→D:___;
②G→E:___;
③F→G:___。
(3)实验室里,常用加热固体混合物的方法制取气体C,请写出化学方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeCl3具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3高效,且腐蚀性小。请回答下列问题:
(1)FeCl3净水的原理是______。FeCl3溶液腐蚀钢铁设备,除H+作用外,另一主要原因是(用离子方程式表示)______。
(2)为节约成本,工业上用NaClO3氧化酸性FeCl2废液得到FeCl3。
①若酸性FeCl2废液中c(Fe2+)=2.0×10-2mol·L-1,c(Fe3+)=1.0×10-3mol·L-1,c(Cl-)=5.3×10-2mol·L-1,则该溶液的pH约为______。
②完成NaClO3氧化FeCl2的离子方程式:
___![]() +___Fe2++___=___Cl+___Fe3++__
+___Fe2++___=___Cl+___Fe3++__
(3)FeCl3在溶液中分三步水解:
Fe3++H2O![]() Fe(OH)2++H+ K1
Fe(OH)2++H+ K1
Fe(OH)2++H2O![]()
![]() +H+ K2
+H+ K2
![]() +H2O
+H2O![]() Fe(OH)3+H+ K3
Fe(OH)3+H+ K3
以上水解反应的平衡常数K1、K2、K3由大到小的顺序是__________。
通过控制条件,以上水解产物聚合,生成聚合氧化铁,离子方程式为:xFe3++yH2O![]() Fex(OH)y(3x-y)++yH+,欲使平衡正向移动可采用的方法是(填序号)______。
Fex(OH)y(3x-y)++yH+,欲使平衡正向移动可采用的方法是(填序号)______。
a.降温 b.加水稀释
c.加入NH4Cl d.加入NaHCO3
室温下,使氯化铁溶液转化为高浓度聚合氯化铁的关键条件是___。
(4)天津某污水处理厂用氯化铁净化污水的结果如下图所示。由图中数据得出每升污水中投放聚合氯化铁[以Fe(mg·L-1)表示]的最佳范围约为_____mg·L-1。
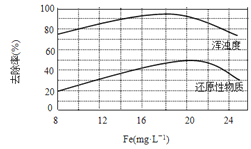
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com