
【题目】运用化学反应原理知识研究如何利用CO、SO2等污染物有重要意义.
(1)用CO可以合成甲醇.已知:
CH3OH(g)+ ![]() O2(g)═CO2(g)+2H2O(l)△H 1 kJmol﹣1
O2(g)═CO2(g)+2H2O(l)△H 1 kJmol﹣1
CO(g)+ ![]() O2(g)═CO2(g)△H2 kJmol﹣1
O2(g)═CO2(g)△H2 kJmol﹣1
H2(g)+ ![]() O2(g)═H2O(l)△H3 kJmol﹣1
O2(g)═H2O(l)△H3 kJmol﹣1
则CO(g)+2H2(g)CH3OH(g)△H=kJmol﹣1 .
(2)一定压强下,在容积为2L的密闭容器中充入1mol CO与2mol H2 , 在催化剂作用下发生反应:CO(g)+2H2(g) CH3OH(g)△H,平衡转化率与温度、压强的关系如图1所示. 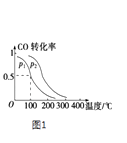
①下列说法正确的是
A.若容器内气体密度恒定,反应达到平衡状态
B.若容器内各气体浓度恒定,反应达到平衡状态
C.上述反应中,△H>0
D.反应中,催化剂使平衡向正反应方向移动
②p2p1 (填“大于”、“小于”或“等于”);
③100℃时,该反应的化学平衡常数K=;
(3)某科研小组用SO2为原料制取硫酸.
①利用原电池原理,用SO2、O2和H2O来制备硫酸,该电池用多孔材料作电极,它能吸附气体,同时也能使气体与电解质溶液充分接触.请写出该电池负极的电极反应式: .
②用Na2SO3溶液充分吸收SO2得NaHSO3溶液,然后电解该溶液可制得硫酸.电解原理示意如图2所示.请写出开始时阳极反应的电极反应式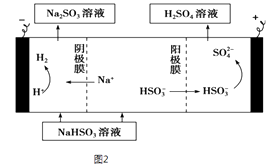
【答案】
(1)2△H3+△H2﹣△H1
(2)B;大于;4
(3)SO2﹣2e﹣+2H2O═SO42﹣+4H+;HSO3﹣+H2O﹣2e﹣=SO42﹣+3H+
【解析】解:(1)①CH3OH(g)+ ![]() O2(g)═CO2(g)+2H2O(l)△H 1 kJmol﹣1②CO(g)+
O2(g)═CO2(g)+2H2O(l)△H 1 kJmol﹣1②CO(g)+ ![]() O2(g)═CO2(g)△H2 kJmol﹣1
O2(g)═CO2(g)△H2 kJmol﹣1
③H2(g)+ ![]() O2(g)═H2O(l)△H3 kJmol﹣1
O2(g)═H2O(l)△H3 kJmol﹣1
根据盖斯定律2×③+②﹣①可得CO(g)+2H2(g)CH3OH(g)△H=2△H3+△H2﹣△H1;
所以答案是:)△H=2△H3+△H2﹣△H1;(2)①A.容器内混合气体总质量不变,恒容气体体积不变,则密度始终不变,故A错误;
B.容器内各气体浓度恒定,反应达到平衡状态,故B正确;
C.由图1可知相同压强下,温度升高,CO的转化率减小,反应逆向移动,正方向为放热反应,故C错误;
D.催化剂不影响化学平衡,故D错误;
所以答案是:B;
②该反应是个气体体积减小的反应,增大压强,化学平衡正向移动,CO的转化率增大,由图1可知相同温度下,p2时CO的转化率大于的p1转化率,故p2大于p1;
所以答案是:大于;
③在容积为2L的密闭容器中充入1mol CO与2mol H2 , 100℃时,该反应的CO的转化率为0.5,列三段式,
CO(g)+ | 2H2(g) | CH3OH(g) | |||
c始: | 0.5 | 1 | 0 | ||
c转: | 0.25 | 0.5 | 0.25 | ||
c平: | 0.25 | 0.5 | 0.25 |
则化学平衡常数K= ![]() =4;
=4;
所以答案是:4;(3)①该原电池中,负极上失电子被氧化,二氧化硫到硫酸,硫的化合价升高,所以负极上投放的气体是二氧化硫,二氧化硫失电子和水反应生成硫酸根离子和氢离子,所以负极上的电极反应式为:SO2﹣2e﹣+2H2O═SO42﹣+4H+;
所以答案是:SO2﹣2e﹣+2H2O═SO42﹣+4H+;
②电解池中阳极和电源正极相连,失去电子,发生氧化反应,电解NaHSO3溶液可制得硫酸,硫的化合价升高,所以阳极是HSO3﹣溶液失去电子被氧化生成SO42﹣ , 则阳极电极反应式是:HSO3﹣+H2O﹣2e﹣=SO42﹣+3H+;
所以答案是:HSO3﹣+H2O﹣2e﹣=SO42﹣+3H+ .
【考点精析】利用化学平衡状态本质及特征和化学平衡的计算对题目进行判断即可得到答案,需要熟知化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效);反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%.


科目:高中化学 来源: 题型:
【题目】用含有A12O3、SiO2和少量FeOxFe2O3的铝灰制备A12(SO4)318H2O.工艺流程如图: 
(一定条件下,MnO4﹣可与Mn2+反应生成MnO2)
已知:生成氢氧化物沉淀的pH
Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
开始沉淀时 | 3.4 | 6.3 | 2.7 |
完全沉淀时 | 5.2 | 9.7 | 3.2 |
(1)H2SO4溶解A12O3的离子方程式是;
(2)检验滤液中还存在Fe2+的方法是(注明试剂、现象).
(3)“除杂”环节有如下几个步骤:
(Ⅰ)向滤液中加入过量KMnO4溶液,调节溶液的pH为3.2;
(Ⅱ)加热,产生大量棕色沉淀,静置,上层溶液呈紫红色:
(Ⅲ)加入MnSO4至紫红色消失,过滤.
①步骤Ⅰ的目的;调节溶液的pH为3.2的目的是 .
②向Ⅱ的沉淀中加入浓HCl并加热,能说明沉淀中存在MnO2的现象是 , 写出其反应方程式;
③Ⅲ中加入MnSO4的目的是 .
(4)从多次循环使用后母液中可回收的主要物质是(填化学式).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸铵广泛应用与工农生产中,其生产流程图如下,回答下列问题: 
(1)在上述工业制硝酸的生产中,B设备的名称是 , 在反应中的氧化产物是 .
(2)此生产过程中,N2与H2合成NH3所用的催化剂是 . 在合成氨的设备(合成塔)中,设置热交换器的目的是;在合成硝酸的吸收塔中通入空气的目的是 .
(3)科学家以氨(NH3)为燃料开发新型的燃料电池.电池中填充可传导O2﹣离子的 MnO3固体电解质,电池总反应为:4NH3+3O2=2N2+6H2O.负极的电极反应式为 .
(4)某化肥厂用NH3制备NH4NO3 . 已知:由NH3制NO的产率是96%、NO制HNO3的产率是92%,则制HNO3所用去的NH3的质量约占总耗NH3质量(不考虑其它损耗)的%.(取两位有效数字)
(5)硝酸铵是一种常用的氮肥,在使用该化肥时避免与碱性肥料一起使用,理由是
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋中有丰富的食品、矿产、能源、药物和水产资源,如图为海水利用的部分过程.下列有关说法不正确的是( ) 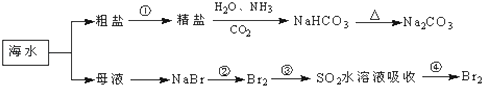
A.工业上通过电解熔融状态MgCl2制取金属镁
B.用澄清的石灰水可鉴别NaHCO3和Na2CO3
C.在第②、④步骤中,溴元素均被氧化
D.制取NaHCO3的反应是利用其溶解度小于NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于丙烯醛(CH2=CH﹣CHO)的下列叙述中,不正确的是( )
A.在丙烯醛分子中,含有两种官能团
B.丙烯醛能发生加聚反应,生成高聚物 ![]()
C.等物质的量的丙烯醛和丙醛完全燃烧,消耗等物质的量的O2
D.丙烯醛能使溴水褪色,能使酸性高锰酸钾溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:①Cl2+2KBr=2KCl+Br2 , ②KClO3+6HCl=3Cl2+KCl+3H2O,③2KBrO3+Cl2=Br2+2KClO3 , 下列说法正确的是( )
A.上述三个反应都有单质生成,所以都是置换反应
B.氧化性由强到弱顺序为 KBrO3>KClO3>Cl2>Br2
C.反应②中还原剂与氧化剂的物质的量之比为6:1
D.③中lmol还原剂反应则氧化剂得到电子的物质的量为2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在反应3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O 中
(1)用单线桥标出电子转移
(2)还原剂是 , 被还原的元素是 , 还原产物是 .
(3)若生成2mol的NO气体,溶液中生成的Cu2+为mol.
(4)在反应中硝酸显示性和性.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学兴趣小组用如图装置进行SO2与FeCl3溶液的反应 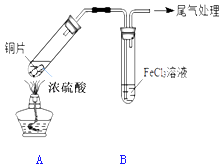
(1)写出装置A中产生SO2的化学方程式: .
(2)该小组同学认为SO2与FeCl3溶液能发生反应的依据是 , 反应前后B中溶液的颜色变化为: .
(3)除了以上性质,你预测FeCl3还可能具有的性质是:(用离子方程式表示,任写一个即可) , 请设计实验证明你的预测(从选择试剂、实验操作、现象及结论进行表述) .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学知识填空
(1)通常用来衡量一个国家的石油化学工业发展水平的标志是年产量.
A.乙烯
B.乙炔
C.乙醇
D.乙烷
(2)写出下列反应的化学方程式,注明反应类型:
①实验室制取乙酸乙酯:
②由苯乙烯制取聚苯乙烯:;反应类型 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com