
【题目】用含有A12O3、SiO2和少量FeOxFe2O3的铝灰制备A12(SO4)318H2O.工艺流程如图: 
(一定条件下,MnO4﹣可与Mn2+反应生成MnO2)
已知:生成氢氧化物沉淀的pH
Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
开始沉淀时 | 3.4 | 6.3 | 2.7 |
完全沉淀时 | 5.2 | 9.7 | 3.2 |
(1)H2SO4溶解A12O3的离子方程式是;
(2)检验滤液中还存在Fe2+的方法是(注明试剂、现象).
(3)“除杂”环节有如下几个步骤:
(Ⅰ)向滤液中加入过量KMnO4溶液,调节溶液的pH为3.2;
(Ⅱ)加热,产生大量棕色沉淀,静置,上层溶液呈紫红色:
(Ⅲ)加入MnSO4至紫红色消失,过滤.
①步骤Ⅰ的目的;调节溶液的pH为3.2的目的是 .
②向Ⅱ的沉淀中加入浓HCl并加热,能说明沉淀中存在MnO2的现象是 , 写出其反应方程式;
③Ⅲ中加入MnSO4的目的是 .
(4)从多次循环使用后母液中可回收的主要物质是(填化学式).
【答案】
(1)Al2O3+6H+=2Al3++3H2O
(2)取少量滤液,滴加KMnO4溶液,KMnO4溶液褪色
(3)将Fe2+氧化为Fe3+;调节pH值使铁元素沉淀完全;有黄绿色气体生成;MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O;除去过量的MnO4﹣
MnCl2+Cl2↑+2H2O;除去过量的MnO4﹣
(4)K2SO4
【解析】解:向铝灰中加入过量稀H2SO4 , A12O3和少量FeOxFe2O3和硫酸反应生成硫酸铝、硫酸铁、硫酸亚铁,SiO2不反应,过滤除去二氧化硅;向滤液中加入过量KMnO4溶液,高锰酸钾把亚铁离子氧化成铁离子,调节溶液的pH约为3.7生成氢氧化铁沉淀,除去铁离子,过滤,滤液中含铝离子和过量的高锰酸根离子,加入硫酸锰把过量高锰酸根离子除去,再过滤,对滤液蒸发浓缩、结晶分离出硫酸铝晶体,(1)硫酸溶解氧化铝生成硫酸铝和水,反应的离子方程式为:Al2O3+6H+=2Al3++3H2O,所以答案是:Al2O3+6H+=2Al3++3H2O;(2)由于铁离子和亚铁离子同时存在,所以检验亚铁离子应该用酸性高锰酸钾溶液,方法为:取少量滤液,滴加KMnO4溶液,KMnO4溶液褪色,
所以答案是:取少量滤液,滴加KMnO4溶液,KMnO4溶液褪色;(3)①向滤液中加入过量KMnO4溶液,目的是氧化亚铁离子为三价铁离子;
依据图表数据分析可知,铁离子开始沉淀和沉淀完全的溶液PH为2.7~3.2,铝离子和亚铁离子开始沉淀的溶液pH大于3.2,所以调节溶液的pH约为3.2,可以使铁离子全部沉淀,铝离子不沉淀分离,
所以答案是:将Fe2+氧化为Fe3+;调节pH值使铁元素沉淀完全;②向Ⅱ的沉淀中加入浓HCl并加热,二氧化锰和浓盐酸在加热条件下反应MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O,生成氯化锰、氯气和水,生成的氯气是黄绿色气体,能说明沉淀中存在MnO2的现象是生成黄绿色气体,
MnCl2+Cl2↑+2H2O,生成氯化锰、氯气和水,生成的氯气是黄绿色气体,能说明沉淀中存在MnO2的现象是生成黄绿色气体,
所以答案是:有黄绿色气体生成;MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O;③MnO4﹣可与Mn2+反应生成MnO2 , 过滤除去,所以可以利用MnSO4的溶液和高锰酸钾溶液反应生成二氧化锰,把过量高锰酸根离子除去,
MnCl2+Cl2↑+2H2O;③MnO4﹣可与Mn2+反应生成MnO2 , 过滤除去,所以可以利用MnSO4的溶液和高锰酸钾溶液反应生成二氧化锰,把过量高锰酸根离子除去,
所以答案是:除去过量的MnO4﹣;(4)反应后,溶液中存在较多的K+、SO42﹣便留在母液中,可回收的主要物质为K2SO4 ,
所以答案是:K2SO4 .


 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:
【题目】摩尔质量是指单位物质的量的物质所具有的质量.
(1)已知O的相对原子质量为16,则O3的摩尔质量为
(2)48gN2H4的物质的量为 , 所含氢原子数目为 .
(3)标准状况下,相同体积的CH4和SO2气体的质量比为;相同质量的CH4和SO2分子个数比为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知同一个碳原子上连有两个羟基是不稳定的,会失水形成羰基.试回答下列问题:
(1)写出 ![]() 在Ag存在和加热条件下与O2反应的化学方程式: .
在Ag存在和加热条件下与O2反应的化学方程式: .
(2)写出丙炔与HBr按1:2的加成产物(氢原子加在含氢较多的碳上)在碱性条件下完全水解后产物的结构简式: .
(3)C5H12O分子属于醇类的同分异构体有种,若向其中加入酸性高锰酸钾溶液无明显现象,则该醇的结构简式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用少量的溴水和足量的乙醇制备1,2﹣二溴乙烷的装置如下图所示: 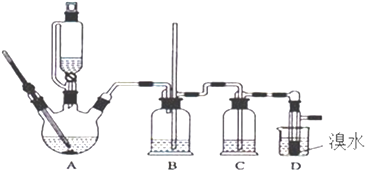
有关数据列表如下:
乙醇 | 1,2﹣二溴乙烷 | 醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/gcm﹣3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | ﹣l30 | 9 | ﹣1l6 |
回答下列问题:
(1)烧瓶A中发生的主要的反应方程式 .
(2)装置B的作用是 .
(3)在装置C中应加入(填字母). a.水 b.浓硫酸 c.饱和碳酸氢钠溶液 d.氢氧化钠溶液
(4)若产物中有少量未反应的Br2 , 最好用(填字母)洗涤除去. a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇 e.Na2SO3溶液
(5)若产物中有少量副产物乙醚,可用的方法除去.
(6)反应过程中应用冷水冷却装置D,但又不能过度冷却(如用冰水),其原因是 .
(7)判断该制备反应已经结束的最简单方法是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相对分子质量为92的某芳香烃X是一种重要的有机化工原料,研究部门以它为初始原料设计出如下转化关系图(部分产物、合成路线、反应条件略去).其中A是一氯代物,H是一种功能高分子,链节组成为C7H5NO
. 
已知:
请根据所学知识与本题所给信息回答下列问题:
(1)反应③的类型是;
(2)写出反应①的化学方程式
(3)写出反应②的化学方程式;
(4) 有多种同分异构体,写出符合下列条件的所有结构简式:;
有多种同分异构体,写出符合下列条件的所有结构简式:;
(i)能发生银镜反应
(ii)遇FeC13溶液呈紫色
(iii)属于芳香族化合物,且苯环上一氯代物只有2 种
(5)参照上述合成路线图,设计由A 到  的合成路线(无机试剂任选)
的合成路线(无机试剂任选)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】验证NH4Cl晶体中含有NH4+ . 将少量晶体于两端开口的硬质玻璃管中加热,如图所示. 
(1)氯化铵受热反应的化学方程式是 .
(2)检验氨气时,可在处(填“a”或“b”)用湿润试纸,现象是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.CHCl2分子的立体构型为正四面体形
B.H2O分子中氧原子的杂化轨道类型为sp2 , 分子的立体构型为V形
C.CO2分子中碳原子的杂化轨道类型为sp,分子的立体构型为直线形
D.NH4+的立体构型为三角锥形
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学反应原理知识研究如何利用CO、SO2等污染物有重要意义.
(1)用CO可以合成甲醇.已知:
CH3OH(g)+ ![]() O2(g)═CO2(g)+2H2O(l)△H 1 kJmol﹣1
O2(g)═CO2(g)+2H2O(l)△H 1 kJmol﹣1
CO(g)+ ![]() O2(g)═CO2(g)△H2 kJmol﹣1
O2(g)═CO2(g)△H2 kJmol﹣1
H2(g)+ ![]() O2(g)═H2O(l)△H3 kJmol﹣1
O2(g)═H2O(l)△H3 kJmol﹣1
则CO(g)+2H2(g)CH3OH(g)△H=kJmol﹣1 .
(2)一定压强下,在容积为2L的密闭容器中充入1mol CO与2mol H2 , 在催化剂作用下发生反应:CO(g)+2H2(g) CH3OH(g)△H,平衡转化率与温度、压强的关系如图1所示. 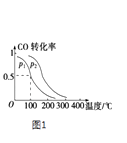
①下列说法正确的是
A.若容器内气体密度恒定,反应达到平衡状态
B.若容器内各气体浓度恒定,反应达到平衡状态
C.上述反应中,△H>0
D.反应中,催化剂使平衡向正反应方向移动
②p2p1 (填“大于”、“小于”或“等于”);
③100℃时,该反应的化学平衡常数K=;
(3)某科研小组用SO2为原料制取硫酸.
①利用原电池原理,用SO2、O2和H2O来制备硫酸,该电池用多孔材料作电极,它能吸附气体,同时也能使气体与电解质溶液充分接触.请写出该电池负极的电极反应式: .
②用Na2SO3溶液充分吸收SO2得NaHSO3溶液,然后电解该溶液可制得硫酸.电解原理示意如图2所示.请写出开始时阳极反应的电极反应式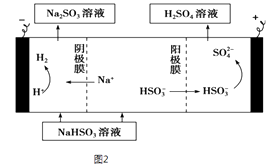
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com