
【题目】电镀废水中常含有剧毒的![]() 。该废水处理的一种方法是利用还原剂把
。该废水处理的一种方法是利用还原剂把![]() 还原成毒性较低的Cr3+,再加碱生成沉淀;另一种方法是向废水中加入适量的NaCl,用Fe作电极进行电解。下列说法错误的是
还原成毒性较低的Cr3+,再加碱生成沉淀;另一种方法是向废水中加入适量的NaCl,用Fe作电极进行电解。下列说法错误的是
A.电解时,阳极反应式为Fe2e===Fe2+
B.电解过程中,阴极能产生氢气
C.电解过程中,![]() 被还原的离子方程式为
被还原的离子方程式为![]() +6Fe2++14H+===2Cr3++6Fe3++7H2O
+6Fe2++14H+===2Cr3++6Fe3++7H2O
D.电解过程中,阳极附近生成Fe(OH)3和Cr(OH)3沉淀
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】一种三室微生物燃料电池污水净化系统原理如图所示,图中有机废水中有机物可用C6H10O5,表示,咸水中的主要溶质为NaCl。下列有关说法正确的是

A. a为原电池的负极
B. b电极附近溶液的pH减小
C. a电极反应式为![]()
D. 中间室:Na+移向左室,Cl-移向右室
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的装置中发生反应2A2(g)+B2(g)2C(g)△H=﹣a kJ/mol(a>0),已知P是可自由滑动的活塞.在相同温度时关闭K,向容积相同的A、B容器中分别都充入2mol A2和1mol B2气体.两容器分别在500℃达平衡时,A中C的浓度为c1 mol/L,放出热量b kJ,B中C的浓度为c2 mol/L,放出热量c kJ.下列说法中正确的是( )
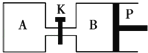
A.500℃达平衡时有:c1>c2
B.500℃达平衡时有:a>b>c
C.达平衡后打开K,容器B的体积将减小
D.此反应的平衡常数随温度升高而增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(Ⅰ)如图所示,甲、乙之间的隔板K和活塞F都可左右移动,甲中充入2molA和1molB,乙中充入2molC和1molHe,此时K停在0处。在一定条件下发生可逆反应:2A(g)+B(g)![]() 2C(g); 反应达到平衡后,再恢复至原温度。回答下列问题:
2C(g); 反应达到平衡后,再恢复至原温度。回答下列问题:
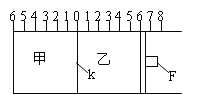
(1)可根据__________现象来判断甲、乙都已达到平衡。
(2)达到平衡时,隔板K最终停留在0刻度左侧a处,则a的取值范围是____________。
(3)若达到平衡时,隔板K最终停留在左侧刻度1处,则甲中C的物质的量为_____mol,乙中C的转化率________50%(填:>、<、=),此时,乙中可移动活塞F最终停留在右侧刻度________处(填下列序号:① <6 ② >6 ③ =6)
(Ⅱ)若一开始就将K、F固定,其它条件均不变,则达到平衡时:
(1)测得甲中A的转化率为b,则乙中C的转化率为_________;
(2)假设乙、甲两容器中的压强比用d表示,则d的取值范围是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量。已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能(kJ/mol):P-P:198,P-O:360,O=O:498,则在反应P4(白磷)+3O2=P4O6中,消耗1mol白磷的能量变化为( )
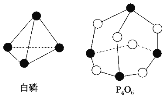
A.吸收1638kJB.放出1638kJC.吸收126kJD.放出126kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(Ⅰ)下图中,P为一可自由滑动的活塞,关闭K,分别向容器A、B中各充入1 mol X、1 mol Y,起始时,VA=a L,VB=0.8a L(连通管的体积忽略不计),在相同温度和有催化剂存在的条件下,两容器中各自发生下述反应:3X(g)+3Y(g)![]() 2Z(g)+2W(g),达平衡时,VB=0.6a L。回答下列问题:
2Z(g)+2W(g),达平衡时,VB=0.6a L。回答下列问题:
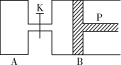
(1)达到平衡时B中X的转化率为________________。
(2)平衡时A、B中混合气体的平均相对分子质量的关系是:MA____________MB(填“>”、“=”或“<”)。
(3)打开K,一段时间后反应再次达到平衡,则B的体积为____________L。
(Ⅱ)工业中采用适当的催化剂利用反应CO(g)+2H2(g)![]() CH3OH(g)来制取甲醇。
CH3OH(g)来制取甲醇。
(4)维持体系的压强一定,温度为T时,在体积为2.0 L的封闭容器内充入0.6 mol CO和0.4 mol H2,达到平衡时含有0.15 mol CH3OH(g),则该反应平衡常数K=________(保留两位小数),此时向容器中再通入0.7 mol CO气体,则此平衡将____________(填“正向”、“不”或“逆向”)移动。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Q、X、Y和Z为短周期元素,它们在周期表中的位置如图所示,这4种元素的原子最外层电子数之和为22。下列说法正确的是
![]()
A. Y的原子半径比X的大
B. Q的最高价氧化物的水化物的酸性比Z的强
C. X、Y和氢3种元素形成的化合物中都只有共价键
D. Q的单质具有半导体的性质,Q与Z可形成化合物QZ4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾天气是一种大气污染状态,雾霾的源头多种多样,比如汽车尾气、工业排放、建筑扬尘、垃圾焚烧,甚至火山喷发等。
(1)汽车尾气中的NO(g)和CO(g)在一定温度和催化剂的条件下可净化。
①已知部分化学键的键能如下
分子式/结构式 | NO/N≡O | CO/C≡O | CO2/O=C=O | N2/N≡N |
化学键 | N≡O | C≡O | C=O | N≡N |
键能( kJ/mol) | 632 | 1072 | 750 | 946 |
请完成汽车尾气净化中NO(g)和CO(g)发生反应的热化学方程式
2NO(g)+2CO( g) ![]() N2( g)+2CO2(g) △H=_____kJ·mol-1
N2( g)+2CO2(g) △H=_____kJ·mol-1
②若上述反应在恒温、恒容的密闭体系中进行,并在t1时刻达到平衡状态,则下列示意图符合题意的是 ____(填选项序号)。(下图中V正、K、n、P总分别表示正反应速率、平衡常数、物质的量和总压强)
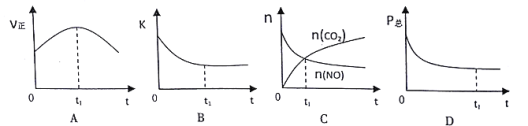
(2)在t1℃下,向体积为10 L的恒容密闭容器中通入NO和CO,测得不同时间NO和CO的物质的量如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/×10-2mol | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
n(CO)/×10-1 mol | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
t1℃时该反应的平衡常数K= ___,既能增大反应速率又能使平衡正向移动的措施是_____。(写出一种即可)
(3)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。在氨气足量的情况下,不同c(NO2)/C(NO)、不同温度对脱氮率的影响如图所示(已知氨气催化还原氮氧化物的正反应为放热反应),请回答温度对脱氮率的影响________,给出合理的解释:____________。
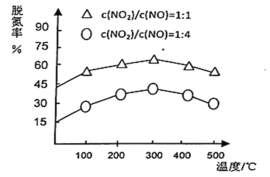
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微生物燃料电池(MFC)是一种现代化氨氮去除技术。下图为MFC碳氮联合同时去除的转化系统原理示意图。下列说法正确的是

A. 好氧微生物反应器中反应为:NH4++2O2==NO3-+2H++H2O
B. B极电势比A极电势低
C. A极的电极反应式CH3COO-+8e-+2H2O==2CO2+7H+
D. 当电路中通过1mol电子时,理论上总共生成2.24LN2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com