
ΓΨΧβΡΩΓΩΩ…ΡφΖ¥”Π 2NO2(g)![]() N2O4 (g)‘ΎΧεΜΐ≤Μ±δΒΡΟή±’»ίΤς÷–Ζ¥”ΠΘ§¥οΒΫΤΫΚβΉ¥Χ§ΒΡ±ξ÷Ψ «
N2O4 (g)‘ΎΧεΜΐ≤Μ±δΒΡΟή±’»ίΤς÷–Ζ¥”ΠΘ§¥οΒΫΤΫΚβΉ¥Χ§ΒΡ±ξ÷Ψ «
ΔΌΒΞΈΜ ±ΦδΡΎ…ζ≥… n mol N2O4 ΒΡΆ§ ±…ζ≥… 2n mol NO2
ΔΎΒΞΈΜ ±ΦδΡΎœϊΚΡ n mol N2O4ΒΡΆ§ ±…ζ≥… 2n mol NO2
ΔέΜλΚœΤχΧεΒΡΤΫΨυœύΕ‘Ζ÷Ή”÷ ΝΩ≤Μ‘ΌΗΡ±δΒΡΉ¥Χ§
ΔήΜλΚœΤχΧεΒΡ―’…Ϊ≤Μ‘ΌΗΡ±δΒΡΉ¥Χ§
Δί”ΟNO2ΓΔN2O4ΒΡΈο÷ ΒΡΝΩ≈®Ε»±δΜ·±μ ΨΒΡΖ¥”ΠΥΌ¬ ΒΡ±»ΈΣ2ΘΚ1 ΒΡΉ¥Χ§
A.ΔΌΔήΔίB.ΔΎΔίC.ΔΌΔέΔήD.ΔΌΔΎΔέΔήΔί
ΓΨ¥πΑΗΓΩC
ΓΨΫβΈωΓΩ
ΔΌΒΞΈΜ ±ΦδΡΎ…ζ≥…nmolN2O4ΒΡΆ§ ±…ζ≥…2nmolNO2Θ§Ά§ ±œϊΚΡnmolN2O4Θ§’ΐΡφΖ¥”ΠΥΌ¬ œύΒ»Θ§Ζ¥”Π¥οΒΫΤΫΚβΉ¥Χ§Θ§Ι ΔΌ’ΐ»ΖΘΜ
ΔΎΈό¬έΖ¥”Π «Ζώ¥οΒΫΤΫΚβΉ¥Χ§ΕΦ¥φ‘ΎΒΞΈΜ ±ΦδΡΎœϊΚΡnmolN2O4ΒΡΆ§ ±…ζ≥…2nmolNO2Θ§≤ΜΡήΨί¥Υ≈–ΕœΤΫΚβΉ¥Χ§Θ§Ι ΔΎ¥μΈσΘΜ
ΔέΖ¥”Π«ΑΚσΤχΧεΉή÷ ΝΩ≤Μ±δΓΔΈο÷ ΒΡΝΩΦθ–ΓΘ§‘ρΜλΚœΤχΧεΤΫΨυΡΠΕϊ÷ ΝΩ‘ω¥σΘ§Β±ΜλΚœΤχΧεΒΡΤΫΨυœύΕ‘Ζ÷Ή”÷ ΝΩ≤Μ‘ΌΗΡ±δΒΡ ±Θ§ΗςΈο÷ ΒΡΈο÷ ΒΡΝΩ≤Μ±δΘ§Ζ¥”Π¥οΒΫΤΫΚβΉ¥Χ§Θ§Ι Δέ’ΐ»ΖΘΜ
ΔήΜλΚœΤχΧεΒΡ―’…Ϊ≤Μ‘ΌΗΡ±δ ±Θ§Εΰ―θΜ·ΒΣ≈®Ε»≤Μ±δΘ§Ζ¥”Π¥οΒΫΤΫΚβΉ¥Χ§Θ§Ι Δή’ΐ»ΖΘΜ
ΔίΈό¬έΖ¥”Π «Ζώ¥οΒΫΤΫΚβΉ¥Χ§ΕΦ¥φ‘ΎNO2ΓΔN2O4ΒΡΈο÷ ΒΡΝΩ≈®Ε»±δΜ·±μ ΨΒΡΖ¥”ΠΥΌ¬ ΒΡ±»ΈΣ2ΘΚ1Θ§≤ΜΡήΨί¥Υ≈–ΕœΤΫΚβΉ¥Χ§Θ§Ι Δί¥μΈσΘΜ
ΔΌΔέΔή’ΐ»ΖΘ§Ι ¥πΑΗΈΣCΓΘ



| ΡξΦΕ | ΗΏ÷–ΩΈ≥Χ | ΡξΦΕ | ≥θ÷–ΩΈ≥Χ |
| ΗΏ“Μ | ΗΏ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ“Μ | ≥θ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏΕΰ | ΗΏΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θΕΰ | ≥θΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏ»ΐ | ΗΏ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ»ΐ | ≥θ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΜΖΨ≥Φύ≤β≤βΕ®Υ°÷–»ήΫβ―θΒΡΖΫΖ® «ΘΚ
ΔΌΝΩ»ΓamLΥ°―υΘ§―ΗΥΌΦ”»κΙΧΕ®ΦΝMnSO4»ή“ΚΚΆΦν–‘KI»ή“Κ(Κ§KOH)Θ§ΝΔΦ¥»ϊΚΟΤΩ»ϊΘ§Ζ¥Η¥’ώΒ¥Θ§ Ι÷°≥δΖ÷Ζ¥”ΠΘ§ΤδΖ¥”Π ΫΈΣΘΚ2Mn2++O2+4OH-=2MnO(OH)2(ΗΟΖ¥”ΠΦΪΩλ)ΓΘ
ΔΎ≤βΕ®ΘΚΩΣ»ϊΚσ―ΗΥΌΦ”»κ1ΓΪ2 mL≈®ΝρΥα(ΥαΜ·Θ§ΧαΙ©H+)Θ§ Ι÷°…ζ≥…I2Θ§‘Ό”Οbmol/LΒΡNa2S2O3»ή“ΚΒΈΕ®(“‘ΒμΖέΈΣ÷Η ΨΦΝ)Θ§œϊΚΡVmLΓΘ”–ΙΊΖ¥”Π ΫΈΣΘΚMnO(OH)2+2I-+4H+=Mn2++I2+3H2OΓΔI2+2S2O32-=2I-+S4O62-ΓΘ
‘ΜΊ¥πΘΚ
Θ®1Θ©ΒΈΕ®Ιΐ≥Χ÷–”ΟΒΫΒΡ≤ΘΝß“«Τς≥ΐΝΥΥα ΫΒΈΕ®ΙήΓΔΦν ΫΒΈΕ®ΙήΆβΜΙ»±…Ό________________________ΓΘ
Θ®2Θ©ΒΈΕ®≤ΌΉς ±Θ§Ήσ ÷ΩΊ÷ΤΒΈΕ®ΙήΘ§”“ ÷__________Θ§―έΨΠ“ΣΉΔ ”__________ΓΘ
Θ®3Θ©ΒΈΕ®(I2ΚΆS2O32-Ζ¥”Π)“‘ΒμΖέΈΣ÷Η ΨΦΝΘ§÷’Βψ ±»ή“Κ”…__________…Ϊ±δΈΣ__________…ΪΓΘ
Θ®4Θ©Υ°÷–»ήΫβ―θΒΡΦΤΥψ Ϋ «__________(“‘g/LΈΣΒΞΈΜ)ΓΘ
Θ®5Θ©≤βΕ® ±Θ§ΒΈΕ®ΙήΨ≠’τΝσΥ°œ¥Β”ΚσΦ¥Φ”ΒΈΕ®ΦΝNa2S2O3»ή“ΚΘ§ΒΦ÷¬≤βΕ®ΫαΙϊ__________(ΧνΓΑΤΪΗΏΓ±ΓΑΤΪΒΆΓ±ΜρΓΑΈό”ΑœλΓ±Θ§œ¬Ά§)ΓΘ
Θ®6Θ©Φ«¬Φ≤βΕ®ΫαΙϊ ±Θ§ΒΈΕ®«Α―ω ”ΩΧΕ»œΏΘ§ΒΈΕ®ΒΫ¥ο÷’Βψ ±”÷Η© ”ΩΧΕ»œΏΘ§ΫΪΒΦ÷¬ΒΈΕ®ΫαΙϊ__________ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ “Έ¬œ¬Θ§Α―œ¬Ν–ΗςΧβΒΡΫαΙϊΧν‘ΎΚαœΏ…œΓΘ
Θ®1Θ©c(OHΘ≠)=1ΓΝ10Θ≠3mol/LΒΡ»ή“ΚΒΡpH=___________________
Θ®2Θ©0.01mol/L HNO3»ή“Κ÷–Θ§Υ°Βγάκ≥ωΒΡH+ΒΡΈο÷ ΒΡΝΩΒΡ≈®Ε»c(HΘΪ)=_________________
Θ®3Θ©Ρ≥»ή“Κ”…Υ°Βγάκ≥ωH+ΒΡΈο÷ ΒΡΝΩΒΡ≈®Ε»c(HΘΪ)= 1ΓΝ10Θ≠5mol/LΘ§‘ρΗΟ»ή“ΚΩ…“‘ «______Θ®ΧνΓΑΝρΥαΓ±ΜρΓΑ¬»Μ·οßΓ±Μρ ΓΑ«β―θΜ·ΡΤΓ± ΜρΓΑ¬»Μ·ΡΤΓ±Θ©»ή“Κ
Θ®4Θ©ΫΪ0.39gΙΐ―θΜ·ΡΤ»ή”ΎΉψΝΩΥ°÷–≤Δ≈δ≥…100 mL»ή“ΚΘ§‘ρ»ή“ΚΒΡpH=_____________
Θ®5Θ©0. 12mol/L HCl»ή“Κ”κ0.1mol/L ΒΡNaOH»ή“ΚΒ»ΧεΜΐΜλΚœΘ§ΜλΚœ“ΚΒΡpH=___________
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ1942 ΡξΘ§Έ“ΙζΜ·ΙΛΉ®Φ“ΚνΒ¬Αώ“‘ NaClΓΔNH3ΓΔCO2 Β»ΈΣ‘≠Νœœ»÷ΤΒΟ NaHCO3Θ§ΫχΕχ…ζ≤ζ≥ω¥ΩΦνΘ§ ΥϊΒΡΓΑΚν œ÷ΤΦνΖ®Γ±ΈΣ άΫγ÷ΤΦνΙΛ“ΒΉω≥ωΝΥΆΜ≥ωΙ±œΉΓΘ”–ΙΊΖ¥”ΠΒΡΜ·―ßΖΫ≥Χ Ϋ»γœ¬ΘΚ
NH3ΘΪCO2ΘΪH2O=NH4HCO3 ΘΜ
NH4HCO3ΘΪNaCl=NaHCO3ΓΐΘΪNH4Cl ΘΜ
2NaHCO3![]() Na2CO3ΘΪCO2ΓϋΘΪH2O
Na2CO3ΘΪCO2ΓϋΘΪH2O
(1)ΓΑΚν œ÷ΤΦνΖ®Γ±Α―Κœ≥…Α±ΚΆ¥ΩΦνΝΫ÷÷≤ζΤΖΝΣΚœ…ζ≤ζΘ§«κ–¥≥ωΙΛ“ΒΚœ≥…Α±ΒΡΜ·―ßΖ¥”ΠΖΫ≥Χ Ϋ_______
(2)ΧΦΥα«βοß”κ±ΞΚΆ ≥―ΈΥ°Ζ¥”ΠΘ§ΡήΈω≥ωΧΦΥα«βΡΤΨßΧεΒΡ‘≠“ρ «_______ΓΘ
aΘ°ΧΦΥα«βΡΤΡ―»ή”ΎΥ°
bΘ°ΧΦΥα«βΡΤ ή»»“ΉΖ÷Ϋβ
cΘ°ΧΦΥα«βΡΤΒΡ»ήΫβΕ»œύΕ‘Ϋœ–ΓΘ§Υυ“‘‘Ύ»ή“Κ÷– Ήœ»ΫαΨßΈω≥ω
(3)Ρ≥ΧΫΨΩΜνΕ·–ΓΉιΗυΨί…œ ω÷ΤΦν‘≠άμΘ§”ϊ÷Τ±ΗΧΦΥα«βΡΤΘ§Ά§―ßΟ«Α¥ΗςΉ‘…ηΦΤΒΡΖΫΑΗΫχ–– Β―ιΓΘ
ΒΎ“ΜΈΜΆ§―ßΘΚΫΪΕΰ―θΜ·ΧΦΤχΧεΆ®»κΚ§Α±ΒΡ±ΞΚΆ ≥―ΈΥ°÷–÷Τ±ΗΧΦΥα«βΡΤΘ§ Β―ιΉΑ÷Ο»γΆΦΥυ Ψ(ΆΦ÷–Φ–≥÷ΓΔΙΧΕ®”ΟΒΡ“«ΤςΈ¥Μ≠≥ω)ΓΘ
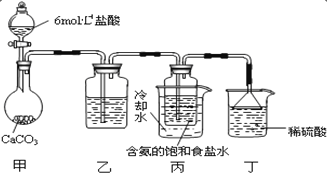
«κΜΊ¥πΘΚ
ΔΌ–¥≥ωΦΉ÷–ΖΔ…ζΖ¥”ΠΒΡάκΉ”ΖΫ≥Χ Ϋ_______ΓΘ
ΔΎ““ΉΑ÷Ο÷–ΒΡ ‘ΦΝ «_______ΓΘ
Δέ Β―ιΫα χΚσΘ§Ζ÷άκ≥ω NaHCO3 ΨßΧεΒΡ≤ΌΉς «_______ (ΧνΖ÷άκ≤ΌΉςΒΡΟϊ≥Τ)ΓΘ
ΒΎΕΰΈΜΆ§―ßΘΚ”Ο»γΆΦΉΑ÷ΟΫχ–– Β―ι(ΤδΥϋΉΑ÷ΟΈ¥Μ≠≥ω)ΓΘ
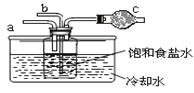
ΔΌΈΣΧαΗΏΕΰ―θΜ·ΧΦ‘Ύ¥ΥΖ¥”Π»ή“Κ÷–±ΜΈϋ ’ΒΡ≥ΧΕ»Θ§ Β―ι ±Θ§–κœ»¥” a ΙήΆ®»κ_______ΤχΧεΘ§‘Ό¥”b Ιή÷–Ά®»κ_______ΤχΧεΓΘ
ΔΎΉΑ÷Ο c ÷–ΒΡ ‘ΦΝΈΣ_______(―ΓΧνΉ÷ΡΗ)ΓΘ
eΘ°Φν ·Μ“ f.Θ°≈®ΝρΥα gΘ°ΈόΥ°¬»Μ·ΗΤ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΜ·―ßΒγ‘¥‘Ύ»’≥Θ…ζΜνΚΆΗΏΩΤΦΦΝλ”ρ÷–ΕΦ”–ΙψΖΚ”Π”ΟΓΘœ¬Ν–ΥΒΖ®’ΐ»ΖΒΡ «
A.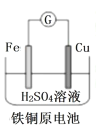 Fe ΑτΈΣΗΚΦΪΘ§ΒγΦΪΖ¥”ΠΈΣ Fe-3e-= Fe3+
Fe ΑτΈΣΗΚΦΪΘ§ΒγΦΪΖ¥”ΠΈΣ Fe-3e-= Fe3+
B.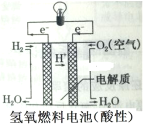 ΡήΙΜΗχ”ΟΒγΤςΧαΙ©Βγ Τ≤νΘ§ «”…”ΎΝΫΗωΒγΦΪ…œ”–ΒΟ ßΒγΉ”ΡήΝΠ≤ΜΆ§ΒΡ«βΤχΚΆ―θΤχ
ΡήΙΜΗχ”ΟΒγΤςΧαΙ©Βγ Τ≤νΘ§ «”…”ΎΝΫΗωΒγΦΪ…œ”–ΒΟ ßΒγΉ”ΡήΝΠ≤ΜΆ§ΒΡ«βΤχΚΆ―θΤχ
C. –ΩΆ≤ΉςΗΚΦΪΘ§ΖΔ…ζΜΙ‘≠Ζ¥”ΠΘ§–ΩΆ≤Μα±δ±Γ
–ΩΆ≤ΉςΗΚΦΪΘ§ΖΔ…ζΜΙ‘≠Ζ¥”ΠΘ§–ΩΆ≤Μα±δ±Γ
D. Ι”Ο“ΜΕΈ ±ΦδΚσΝρΥα«Π≥ΝΒμ‘ΎΒγΦΪΑε…œΘ§»ή“ΚΥα–‘Φθ»θΘ§ΒΦΒγΡήΝΠœ¬ΫΒ
Ι”Ο“ΜΕΈ ±ΦδΚσΝρΥα«Π≥ΝΒμ‘ΎΒγΦΪΑε…œΘ§»ή“ΚΥα–‘Φθ»θΘ§ΒΦΒγΡήΝΠœ¬ΫΒ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ1Θ§2©¹ΜΖ―θΕΓΆι»γΆΦΘ§Ά®≥ΘΈΣΈό…Ϊ“ΚΧεΘ§”Ο”Ύ÷Τ‘λ≈ίΡ≠ΥήΝœΓΔΚœ≥…œπΫΚΓΔΖ«άκΉ”–Ά±μΟφΜν–‘ΦΝΒ»ΓΘœ¬Ν–ΙΊ”Ύ1Θ§2©¹ΜΖ―θΕΓΆιΒΡΥΒΖ®≤Μ’ΐ»ΖΒΡ «Θ® Θ©
![]()
A. Μ·―ß ΫΈΣC4H8O
B. ―θ‘≠Ή””κΥυ”–ΧΦ‘≠Ή”Ω…Ρή¥Π”ΎΆ§“ΜΤΫΟφ
C. ΡήΖΔ…ζ―θΜ·Ζ¥”ΠΚΆ»Γ¥ζΖ¥”Π
D. Εΰδε¥ζΈοΒΡΫαΙΙ”–9÷÷Θ®≤ΜΩΦ¬«ΝΔΧε“λΙΙΘ©
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ±ΫΦΉ»©Θ®ΈΔ»ή”ΎΥ°ΓΔ“Ή»ή”Ύ”–Μζ»ήΦΝΘ§ΟήΕ»‘ΦΒ»”ΎΥ°ΒΡΟήΕ»Θ©‘ΎΦν–‘ΧθΦΰœ¬ΖΔ…ζΤγΜ·Ζ¥”ΠΩ…“‘÷Τ±Η±ΫΦΉ¥ΦΘ®‘ΎΥ°÷–»ήΫβΕ»≤Μ¥σΓΔ“Ή»ή”Ύ”–Μζ»ήΦΝΘ§ΟήΕ»‘ΦΒ»”ΎΥ°ΒΡΟήΕ»Θ©ΚΆ±ΫΦΉΥαΓΘΖ¥”Π‘≠άμ»γœ¬ΘΚ2C6H5CHO+NaOHΓζC6H5CH2OH+C6H5COONaΓΔC6H5COONa+HClΓζC6H5COOH+NaClΘ§”–ΙΊΈο÷ Έοάμ–‘÷ »γ±μΘΚ
±ΫΦΉ»© | ±ΫΦΉ¥Φ | ±ΫΦΉΥα | ±Ϋ | |
Ζ–Βψ/Γφ | 178 | 205 | 249 | 80 |
»έΒψ/Γφ | 26 | ©¹15 | 12 | 5.5 |
±ΫΦΉΥα‘ΎΥ°÷–ΒΡ»ήΫβΕ» | ||
17Γφ | 25Γφ | 100Γφ |
0.21 g | 0.34 g | 5.9 g |
Β―ιΝς≥Χ»γœ¬ΘΚ
Θ®1Θ©ΒΎΔΌ≤Ϋ–ηΝ§–χΦ”»»1–Γ ±Θ®»γΆΦ1Θ©Θ§Τδ÷–Φ”»»ΚΆΙΧΕ®ΉΑ÷ΟΈ¥Μ≠≥ωΓΘ»τΫΪ“«ΤςBΗΡΈΣ“«ΤςCΘ§–ßΙϊ≤Μ»γBΘ§ΥΒΟς‘≠“ρ________ΓΘ

Θ®2Θ©≤ΌΉς÷–”–ΙΊΖ÷“Κ¬©ΕΖΒΡ Ι”Ο≤Μ’ΐ»ΖΒΡ «___ΓΘ
AΘ°Ζ÷“Κ¬©ΕΖ‘Ύ Ι”Ο÷°«Α±Ί–κΦλ≤ι «Ζώ¬©Υ°
BΘ°Ζ÷“Κ¬©ΕΖΡΎΒΡ“ΚΧε≤ΜΡήΙΐΕύΘ§Ζώ‘ρ≤Μάϊ”Ύ’ώΒ¥
CΘ°≥δΖ÷’ώΒ¥ΚσΫΪΖ÷“Κ¬©ΕΖ÷Ο”ΎΧζΦήΧ®…œΨ≤÷ΟΘ§Ζ÷≤ψΚσΝΔΦ¥¥ρΩΣ–ΐ»ϊΫχ––Ζ÷“Κ
DΘ°Ζ÷“Κ ±Β»œ¬≤ψ“ΚΧεΖ≈ΆξΚσΝΔΦ¥ΙΊ±’–ΐ»ϊΘ§ΜΜ“ΜΗω…’±≠‘Ό¥ρΩΣ–ΐ»ϊ Ι…œ≤ψ“ΚΧεΝςœ¬
Θ®3Θ©≤ΌΉςΔέ”ΟΖ–Υ°‘ΓΦ”»»’τΝσΘ§‘ΌΫχ––≤ΌΉςΔήΘ®»γΆΦ2Θ©Θ§ ’Φ·___ΓφΒΡΝσΖ÷ΓΘΆΦ2÷–”–“Μ¥ΠΟςœ‘¥μΈσΘ§’ΐ»ΖΒΡ”ΠΗΡΈΣ_______ΓΘ
Θ®4Θ©≥ι¬Υ ±Θ®»γΆΦ3Θ©…’±≠÷–±ΫΦΉΥαΨßΧεΉΣ»κ≤Φ œ¬©ΕΖ ±Θ§±≠±Ύ…œΜΙ’≥”–…ΌΝΩΨßΧεΘ§”Ο___≥εœ¥±≠±Ύ…œ≤–ΝτΒΡΨßΧεΘ§≥ι¬ΥΆξ≥…Κσœ¥Β”ΨßΧεΓΘ
Θ®5Θ©”ΟΒγΉ”ΧλΤΫΉΦ»Ζ≥Τ»Γ0.244 0 g±ΫΦΉΥα―υΤΖ”ΎΉΕ–ΈΤΩ÷–Θ§Φ”100 mL’τΝσΥ°»ήΫβΘ®±Ί“Σ ±Ω…“‘Φ”»»Θ©Θ§‘Ό”Ο0.100 0 molL©¹1ΒΡ±ξΉΦNaOH»ή“ΚΒΈΕ®Θ§Ι≤œϊΚΡNaOH»ή“Κ19.20 mLΘ§‘ρ±ΫΦΉΥα―υΤΖΒΡ¥ΩΕ»ΈΣ___%Θ®±ΘΝτ4ΈΜ”––ß ΐΉ÷Θ©ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩSiO2 «“Μ÷÷Μ·ΙΛ‘≠ΝœΘ§Ω…“‘÷Τ±Η“ΜœΒΝ–Έο÷ Θ§œ¬Ν–ΥΒΖ®’ΐ»ΖΒΡ «
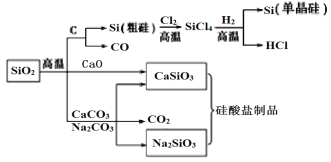
A. ΆΦ÷–Υυ”–Ζ¥”ΠΕΦ≤Μ τ”Ύ―θΜ·ΜΙ‘≠Ζ¥”Π
B. ΙηΥα―ΈΒΡΜ·―ß–‘÷ Έ»Ε®Θ§≥Θ”Ο”Ύ÷Τ‘λΙβΒΦœΥΈ§
C. Ω…”Ο―ΈΥα≥ΐ»Ξ ·”Δ…ΑΘ®÷ς“Σ≥…Ζ÷ΈΣSiO2Θ©÷–…ΌΝΩΒΡΧΦΥα―Έ
D. Τ’Ά®≤ΘΝß «”…¥ΩΦνΓΔ ·Μ“ ·ΚΆ ·”Δ÷Τ≥…ΒΡΘ§Τδ»έΒψΚήΗΏ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΓΣΕ®Έ¬Ε»œ¬,‘Ύ»ΐΗωΒ»ΧεΜΐΒΡΚψ»ίΟή±’»ίΤς÷–Θ§Ζ¥”Π2CO2(g)+ 6H2(g)![]() C2H5OH(g)+3H2O(g)¥οΤΫΚβΓΘœ¬Ν–ΥΒΖ®’ΐ»ΖΒΡ «
C2H5OH(g)+3H2O(g)¥οΤΫΚβΓΘœ¬Ν–ΥΒΖ®’ΐ»ΖΒΡ «
»ίΤς | Έ¬Ε»/K | Έο÷ ΒΡΤπ Φ≈®Ε»(molΓΛL-1) | Έο÷ ΒΡΤΫΚβ≈®(molΓΛL-1) | |||
CO2(g) | H2(g) | C2H5OH(g) | H2O(g) | C2H5OH(g) | ||
ΦΉ | 500 | 0.20 | 0.60 | 0 | 0 | 0.083 |
““ | 500 | 0.40 | 0.60 | 0 | 0 | |
±ϊ | 600 | 0 | 0 | 0.10 | 0.30 | 0.039 |
A. ΗΟΖ¥”Π’ΐΖ¥”ΠΈΣΈϋ»»Ζ¥”Π
B. ¥οΤΫΚβ ±,ΦΉΓΔ““»ίΤςΡΎΘΚ2c(C2H5OH ,ΦΉ)©³c(C2H5OH ,““)
C. ¥οΤΫΚβ ±,»ίΤςΦΉ÷–ΒΡΡφΖ¥”ΠΥΌ¬ ±»»ίΤς““÷–ΒΡ¥σ
D. ¥οΤΫΚβ ±,ΉΣΜ·¬ ΘΚa(CO2,ΦΉ)+a(C2H5OH,±ϊ)>1
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΙζΦ ―ß–Θ”≈―Γ - ΝΖœΑ≤αΝ–±μ - ‘ΧβΝ–±μ
Κΰ±± ΓΜΞΝΣΆχΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΤΫΧ® | Άχ…œ”–ΚΠ–≈œΔΨΌ±®Ή®«χ | Βγ–≈’©Τ≠ΨΌ±®Ή®«χ | …φάζ Ζ–ιΈό÷ς“ε”–ΚΠ–≈œΔΨΌ±®Ή®«χ | …φΤσ«÷»®ΨΌ±®Ή®«χ
ΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΒγΜΑΘΚ027-86699610 ΨΌ±®” œδΘΚ58377363@163.com