
【题目】某溶液中可能含有SO42-、CO32-、Cl-。为了检验其中是否含有SO42-,除BaCl2溶液外,还需要的溶液是
A.H2SO4 B.HCl C.NaOH D.NaNO3
科目:高中化学 来源: 题型:
【题目】氨氧化法是工业生产中制取硝酸的主要途径,某同学用该原理在实验室探究硝酸的制备和性质,设计了如下图所示的装置:
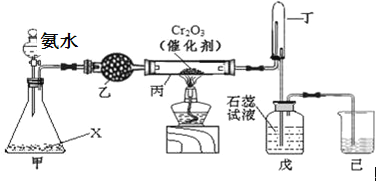
(1)若分液漏斗中氨水的浓度为9.0molL﹣1,配制该浓度的氨水100mL,用到的玻璃仪器有100mL容量瓶、烧杯、玻璃棒、 。
(2)甲装置不需要加热即能同时产生氨气和氧气,烧瓶内固体X的名称为 。
(3)乙装置的作用是 ;写出受热时丙装置发生反应的化学方程式为 。
(4)当戊中观察到 现象,则说明已制得硝酸。某同学按上图组装仪器并检验气密性后进行实验,没有观察到此现象,请分析实验失败的可能原因 。如何改进置 。
(5)改进后待反应结束,将丁装置倒立在盛水的水槽中,会观察到的现象是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某一恒温恒容的密闭容器中发生如下反应:3H2(g)+N2(g) ![]() 2NH3(g) △H<0。t1时刻到达平衡后,在t2时刻改变某一条件,其反应过程如下图所示。下列说法正确的是( )
2NH3(g) △H<0。t1时刻到达平衡后,在t2时刻改变某一条件,其反应过程如下图所示。下列说法正确的是( )
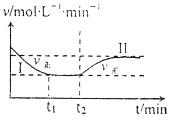
A.I、II两过程达到平衡时,平衡常数:KI<KII
B.I、II两过程达到平衡时,NH3的体积分数:I<II
C.I、II两过程达到平衡的标志:气体密度不再发生变化
D.t2时刻改变的条件可以是向密闭容器中加H2和N2混合气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.1 mol某烃在氧气中完全燃烧,将生成物全部通入浓硫酸中,浓硫酸增重9 g,继续通入足量的澄清石灰水中,得到沉淀50 g。求:
(1)该有机化合物的分子式
(2)若分子中只有两个甲基且属于不饱和烃,写出其结构简式(任写两种)
、 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】联氨(又称联肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料,回答下列问题:
(4)联氨为二元弱碱,在水中的电离方程式与氨相似,联氨第一步电离反应的平衡常数值为_______(已知:N2H4+H+![]() N2H5+的K=8.7×107;KW=1.0×10-14)。联氨与硫酸形成的酸式盐的化学式为 。
N2H5+的K=8.7×107;KW=1.0×10-14)。联氨与硫酸形成的酸式盐的化学式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2016届厦门一模】[化学——选修3:物质结构与性质]NO2+和NO2都是常见的配位体,易与金属结合生成配合物。
(1)基态氧原子核外未成对电子数有__________个,基态氮原子的核外电子轨道示意图为__________。
(2)NO2+和NO2-中氮原子的杂化轨道类型分别为__________。
(3)为消除雾霾利用金属氧化物吸收氮的氧化物,MgO、BaO、CaO、SrO吸收氮的氧化物能力由强到弱的顺序为____________。
(4)下表为含氧酸根XO4n-的键长数据:
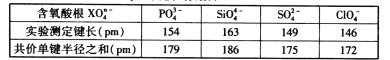
PO43-的空间构型为________。X-O之间的实测键长与理论键长有差异,其原因可能为X-O之间形成了多重键:首先是X原子的________轨道与O原子的2p轨道形成________键;其次是X原子的__________轨道与O原子的2p轨道形成________键。
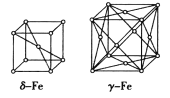
(5)铁有δ、γ两种晶体,如右图所示。两种晶体中距离最近的铁原子间距相同。δ -Fe中铁原子的配位数为__________,δ-Fe和γ-Fe的密度之比为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】参考下列(a)~(c)项回答问题:
(a)皂化值是使1g油脂皂化所需要的KOH的毫克数。
(b)碘值是使100g油脂加成碘的克数。
(c)各种油脂的皂化值、碘值列表如下:
花生油 | 亚麻仁油 | 牛油 | 黄油 | 硬化大豆油 | 大豆油 | |
皂化值 | 190 | 180 | 195 | 226 | 193 | 193 |
碘值 | 90 | 182 | 38 | 38 | 5 | 126 |
(1)单纯由(C17H33COO)3C3H5(相对分子质量884)形成的油,皂化值是
(2)在横线上填入适当的词句:
亚麻仁油比花生油所含的_________________多,黄油比牛油的_________________小。硬化大
豆油的碘值小的原因是_________ ________。
(3)为使碘值为180的鱼油100 g硬化所需要的H2的体积为 升(标准状况下)?
(4)结构简式为 的酯,若皂化值为430,求n为
的酯,若皂化值为430,求n为
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是巨大的资源宝库,从海水中提取食盐和溴的过程如下图所示:

(1)请列举海水淡化的一种方法____________。
(2)将NaCl溶液进行电解,在电解槽中可直接得到的产品有H2、________、________。
(3)步骤Ⅰ中已经获得Br2,步骤Ⅱ中又将获得的Br2还原为Br-,其目的是____________。
(4)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,该反应的离子方程式为_____________________________________。由此反应可知,除保护环境外,在工业生产中还应解决的问题是__________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.化合物Mg5Al3(OH)19(H2O)4可作环保型阻燃材料,受热时按如下化学方程式分解:
2Mg5Al3(OH)19(H2O)4 ![]() 27H2O↑+10MgO+3Al2O3
27H2O↑+10MgO+3Al2O3
(1)写出该化合物作阻燃剂的两条依据____________。
(2)用离子方程式表示除去固体产物中Al2O3 的原理________。
(3)已知MgO可溶于NH4Cl的水溶液,用化学方程式表示其原理____________。
Ⅱ.磁性材料A是由两种元素组成的化合物,某研究小组按如图流程探究其组成:
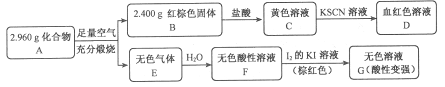
请回答:
(1)A的组成元素为_________(用元素符号表示),化学式为______。
(2)溶液C可溶解铜片,例举该反应的一个实际应用____________。
(3)已知化合物A能与稀硫酸反应,生成一种淡黄色不溶物和一种气体(标况下的密度为1.518 g·L-1),该气体分子的电子式为____。写出该反应的离子方程式__________。
(4)写出F→G反应的化学方程式_____________。设计实验方案探究溶液G中的主要微粒(不考虑H2O、H+、K+、I-)______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com