
【题目】欲用18.4mol·L-1的浓硫酸配制250 mL 0.2 mol·L-1的硫酸溶液,完成下列问题:
(1)所需的主要仪器有__________________________________________________。
(2)根据计算,所取18.4mol·L-1的浓硫酸的体积为________mL,稀释浓硫酸的正确操作方法是____________________________________________________________。
(3)下列操作会使所配制硫酸浓度偏低的是________。
A.转移溶液时未洗涤烧杯与玻璃棒
B.容量瓶水洗后未干燥
C.定容时加水越过刻度线
D.定容时仰视刻度线
【答案】250mL容量瓶、量筒、烧杯、玻璃棒、胶头滴管 2.7 将浓硫酸沿烧杯壁缓慢倒入水中,边加边搅拌 ACD
【解析】
(1)配制250 mL 0.2 mol·L-1的硫酸溶液的步骤为:计算→量取→稀释、冷却→移液→定容→摇匀→装瓶→贴签,根据步骤列出所需要仪器;
(2)根据c=![]() 进行计算;
进行计算;
(3)根据c=![]() 分析不当操作对n或V的影响。
分析不当操作对n或V的影响。
(1)配制250 mL 0.2 mol·L-1的硫酸溶液的步骤为:计算→量取→稀释、冷却→移液→定容→摇匀→装瓶→贴签,需要使用的仪器有:250mL容量瓶、量筒、烧杯、玻璃棒、胶头滴管;
(2)密度ρ=1.84g/mL,质量分数为98%的浓硫酸的浓度为:c=![]() =
=![]() mol/L=18.4mol/L,配制250 mL 0.2 mol·L-1的硫酸溶液,需要该浓硫酸的体积为:
mol/L=18.4mol/L,配制250 mL 0.2 mol·L-1的硫酸溶液,需要该浓硫酸的体积为:![]() ≈0.0072L=7.2mL;
≈0.0072L=7.2mL;
稀释浓硫酸的正确操作方法是将浓硫酸沿烧杯壁缓慢倒入水中,边加边搅拌;
(3)A.转移溶液后未洗涤烧杯和玻璃棒,导致部分溶质损耗,溶质的物质的量偏小,溶液浓度偏低,选项A符合;
B.移液前容量瓶中有少量蒸馏水,对溶质的物质的量和溶液体积都不产生影响,选项B不符合;
C.定容时加水加多了,溶液体积偏大,导致浓度偏低,选C符合;
D.定容时仰视刻度线,导致溶液体积偏大,溶液浓度偏低,选项D符合;
答案选ACD。


科目:高中化学 来源: 题型:
【题目】海洋是一个巨大的化学资源宝库,从海水中可制取氯、溴、碘及其化工产品。
(1)氯的原子结构示意图是___。
(2)碘在元素周期表中的位置是___。
(3)向浓缩的海水中通入Cl2,可将Br﹣转化为Br2.该反应的离子方程式是___。
(4)用热空气将上述过程中产生的Br2吹出,并用浓Na2CO3溶液吸收,生成NaBr、NaBrO3等;再将混合溶液用稀硫酸酸化得到Br2,得到Br2的离子方程式是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由N、P、Ti等元素组成的新型材料有着广泛的用途,请回答下列问题。
(1)钛元素基态原子未成对电子数为____个,能量最高的电子占据的能级符号为__。
(2)磷的一种同素异形体—白磷(P4)的立体构型为____,推测其在CS2中的溶解度____(填“大于”或“小于”)在水中的溶解度。
(3)两种三角锥形气态氢化物膦(PH3)和氨(NH3)的键角分别为93.6°和107°,试分析PH3的键角小于NH3的原因:________。
(4)工业上制金属钛采用金属还原四氯化钛。先将TiO2(或天然的金红石)和足量炭粉混合加热至1000~1100K,进行氯化处理,生成TiCl4。写出生成TiCl4的化学反应方程式:______。
(5)有一种氮化钛晶体的晶胞如图所示,该晶体的化学式为____,已知晶体的密度为pg·cm-3,阿伏加德罗常数为NA,则晶胞边长为____cm(用含p、NA的式子表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组请你参与“研究铁与水反应所得固体物质的成分、性质及再利用”实验探究,并共同回答下列问题:
探究一设计如图所示装置进行“铁与水反应”的实验(夹持仪器略)。
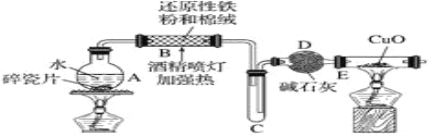
(1)硬质玻璃管B中发生反应的化学方程式为____________。
(2)反应前A中投放碎瓷片的目的是_______。
(3)装置E中的现象是____________。
探究二设计如下实验方案确定反应后硬质玻璃管B中黑色固体的成分。
(4)待硬质玻璃管B冷却后,取少许其中的固体物质溶于___后,将所得溶液分成两份。
(5)一份滴加几滴KSCN溶液。若溶液变红色,推断硬质玻璃管B中固体物质的成分为____ (填序号,下同);若溶液未变红色,推断硬质玻璃管B中固体物质的成分为______。
①一定有Fe3O4 ②一定有Fe ③只有Fe3O4 ④只有Fe
(6)另一份用胶头滴管加入_______(填试剂和现象),可以证明溶液中存在Fe2+。
探究三设计如下流程测定反应后硬质玻璃管B中固体含铁元素的质量分数。
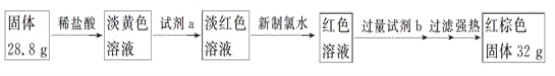
(7)试剂b的化学式是____________。
(8)计算反应后B装置中铁元素的质量分数为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应属于右图阴影部分的是( )
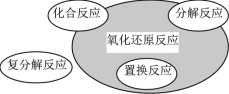
A.CO2+2Mg![]() 2MgO+C
2MgO+C
B.2NaCl+2H2O![]() 2NaOH+Cl2↑+H2↑
2NaOH+Cl2↑+H2↑
C.2NaHCO3![]() Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
D.4Fe(OH)2+O2+2H2O=4Fe(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用海洋资源获得的部分物质如下图所示,有关说法正确的是
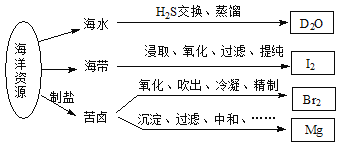
A. 在化学反应中,![]() H2O可转变为D2O
H2O可转变为D2O
B. “加碘食盐”生产中碘添加剂为单质I2
C. 实验室用带玻璃塞的棕色瓶贮存液Br2
D. 电解饱和MgCl2溶液时在阴极得到Mg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有V L 0.5 mol·L-1的盐酸,欲将其浓度扩大一倍,以下方法中最宜采用的是( )
A.加热浓缩到原来体积的一半B.加入5 mol·L-1的盐酸0.125V L
C.加入10 mol·L-1的盐酸0.1V L,再稀释至1.5V LD.标况下通入11.2 L氯化氢气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将某浅黄色固体(由X、Y两种元素组成)和焦炭混合,加热,发生反应,其装置如图所示。先通入氮气,再点燃I、Ⅲ中的酒精灯,实验中观察到I中生成银白色金属,Ⅱ、Ⅳ中溶液变浑浊、Ⅲ中黑色粉末变成红色。下列叙述不正确的是
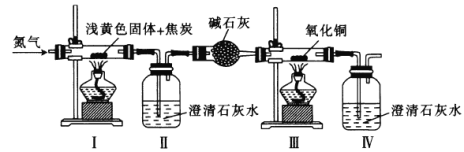
A.X可能是钠元素,Y一定是氧元素
B.浅黄色固体与焦炭在高温下反应生成CO2和CO
C.先通入氮气的目的是排尽装置中的空气
D.用燃烧法处理Ⅳ排放的尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置甲是某可充电电池的示意图,该电池放电的化学方程式为2K2S2+KI3=K2S4+3KI,图中的离子交换膜只允许K+通过,C、D、F均为石墨电极,E为铜电极。工作一段时间后,断开K,此时C、D两电极产生的气体体积相同,E电极质量减少 1.28 g。

(1)装置甲的A电极为电池的__极,电解质的K+向__(填“左侧”或“右侧”)迁移;B电极的电极反应式为____。
(2)装置乙中D电极析出的气体是___,体积为____mL(标准状况)。
(3)若将装置丙中的NaCl溶液改换成FeCl2和FeCl3的混合溶液。从反应初始至反应结束,丙装置溶液中金属阳离子物质的量浓度与转移电子的物质的量的变化关系如图所示。
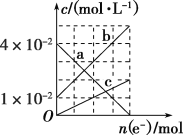
①图中b表示的是_____(填金属离子符号)的变化曲线。
②反应结束后,若用0.5 mol·L-1NaOH溶液沉淀丙装置溶液中的金属阳离子(设溶液体积为100 mL),则至少需要0.5 mol·L-1NaOH溶液______mL。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com