
| V |
| Vm |
| m |
| M |
| N |
| NA |
| n |
| V |
| V×10-3L |
| 22.4L/mol |
| V×10-3L |
| 22.4L/mol |
| V×10-3L |
| 22.4L/mol |
| V×10-3L |
| 22.4L/mol |
| V×10-3L |
| 22.4L/mol |
| 3V |
| 5600 |
| 3V |
| 5600 |
| V×10-3L |
| 22.4L/mol |
| NAV |
| 5600 |
| NAV |
| 5600 |
| V×10-3L |
| 22.4L/mol |
| ||
| Vρ |
| 17 |
| 224ρ |
| ||
| V×10-3L |
| 1 |
| 22.4 |
| 17 |
| 224ρ |
| 1 |
| 22.4 |


科目:高中化学 来源: 题型:
| A、氨的催化氧化是一种特殊的固氮方式 |
| B、工业冶炼铝:电解熔融AlCl3固体 |
| C、将铁粉加入FeCl3、CuCl2混合溶液中,充分反应后剩余的固体中不一定有铁 |
| D、用加热分解的方法可将NH4Cl固体和Ca(OH)2固体的混合物分离 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、制备高铁酸钾用ClO-做还原剂 |
| B、制备高铁酸钾时1mol Fe(OH)3得到3 mol 电子 |
| C、用高铁酸钾处理水时,其氧化产物能水解产生具有强吸附能力的胶体 |
| D、高铁酸钾中铁的化合价为+6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、含氧酸的酸性H3ZO4>H2YO4>HXO4 |
| B、非金属性Z>Y>X |
| C、原子半径Z>Y>X |
| D、气态氢化物的稳定性按X、Y、Z的顺序增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
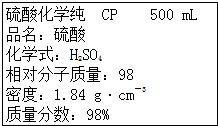
| A、该硫酸的浓度为9.2 mol?L-1 | ||
| B、配制200 mL 4.6 mol?L-1的稀H2SO4需该H2SO4 50 mL | ||
| C、该硫酸与等体积水混合质量分数变为49% | ||
D、取该硫酸100 mL,则浓度变为原来的
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、通入标准状况下的HCl气体11.2V L |
| B、加入10 mol?L-1的盐酸0.1V L,再稀释至1.5V L |
| C、将溶液加热浓缩到0.5V L |
| D、加入V L 1.5 mol?L-1的盐酸混合均匀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、10℃200mL 3mol/L的X溶液 |
| B、20℃300mL 2mol/L的X溶液 |
| C、20℃10mL 4mol/L的X溶液 |
| D、10℃10mL 2mol/L的X溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com