
【题目】某pH =1的溶液X,其中可能含有Al3+、Fe2+、Fe3+、Ba2+、NH4+、CO32-、SO42-、SiO32-、NO3-中的一种或几种,取500 mL该溶液进行实验,其现象及转化如图所示。
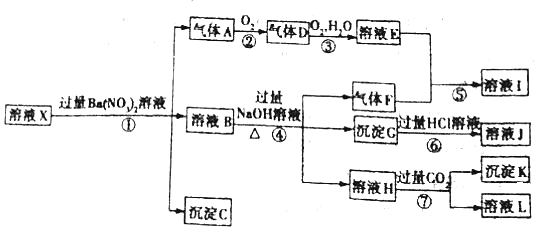
已知:反应过程中有一种气体是红棕色。请回答下列问题:
(1)仅由强酸性条件便可判断溶液X中一定不存在的离子有______。
(2)溶液X中,关于NO3-的判断一定正确的是______![]() 填字母
填字母![]() 。
。
a.一定有
b.一定没有
c.可能有
(3)反应①中产生气体A的离子方程式为______。
(4)反应⑦中生成沉淀K的离子方程式为______。
(5)溶液X中不能确定的离子是______。
(6)若实验测定A、F、K均为0.01 mol,试确定沉淀C是______,其物质的量范围是______。
【答案】CO32-、SiO32- b 3Fe2+ + NO3- + 4H+ = 3Fe3+ + NO↑ + 2H2O CO2 + AlO2- + 2H2O = Al(OH)3↓ + HCO3- Fe3+ BaSO4 ≥0.075 mol
【解析】
某强酸性溶液X,则溶液中不存在弱酸根离子CO32-、SiO32-,溶液和硝酸钡溶液反应生成沉淀C,则溶液呈存在SO42-,不存在和硫酸根离子反应的Ba2+,C是BaSO4;酸性条件下硝酸根离子具有强氧化性,所以溶液中Fe2+和NO3-不能共存,加入硝酸钡产生气体,则溶液中存在Fe2+,不存在NO3-,A是NO;溶液B中加入氢氧化钠溶液时,产生气体F,则溶液中含有NH4+,F是NH3,产生沉淀,则溶液中存在Fe3+,沉淀G是Fe(OH)3,氢氧化铁和盐酸反应生成FeCl3,则J是FeCl3,溶液H中通入过量二氧化碳生成沉淀,则溶液中存在Al3+,沉淀K是Al(OH)3,溶液L是NaHCO3;A是NO,则D是NO2,二氧化氮化和水反应生成硝酸和NO,则E是HNO3,硝酸和氨气反应生成硝酸铵,则I是NH4NO3,以此解答该题。
⑴由强酸性条件即可判断溶液X中一定不存在弱酸根离子,所以不存在的离子有CO32-、SiO32-,故答案为:CO32-、SiO32-。
⑵强酸性溶液中硝酸根离子具有强氧化性,如果存在硝酸根离子,则不存在亚铁离子,加入硝酸钡溶液时不能产生气体,所以溶液X中一定没有NO3-,故答案为:b。
⑶亚铁离子和硝酸反应生成铁离子、一氧化氮和水,离子反应方程式为:
3Fe2+ + NO3- + 4H+ = 3Fe3+ + NO↑ + 2H2O,故答案为:3Fe2+ + NO3- + 4H+ = 3Fe3+ + NO↑ + 2H2O。
⑷⑦中生成沉淀K的离子方程式为CO2 + AlO2- + 2H2O = Al(OH)3↓ + HCO3-,故答案为:CO2 + AlO2- + 2H2O = Al(OH)3↓ + HCO3-。
⑸溶液中存在Fe2+,可被氧化生成Fe3+,则不能确定原溶液是否含有Fe3+;故答案为:Fe3+。
![]() 、F、K均为0.01 mol,500 mL X溶液中n(H+)=0.05mol,根据反应3Fe2+ + NO3- + 4H+ = 3Fe3+ + NO↑ + 2H2O,可知亚铁离子为0.03mol,根据溶液电中性可知:
、F、K均为0.01 mol,500 mL X溶液中n(H+)=0.05mol,根据反应3Fe2+ + NO3- + 4H+ = 3Fe3+ + NO↑ + 2H2O,可知亚铁离子为0.03mol,根据溶液电中性可知:
3n(Al3+)+2 n(Fe2+) + n(NH4+) + n(H+) = 2n(SO42-),n(SO42-) =![]() ,当X溶液中不能确定的离子是Fe3+,则硫酸根离子的物质的量大于0.075 mol,生成沉淀C硫酸钡的物质的量大于0.075 mol;故答案为:BaSO4;≥0.075 mol。
,当X溶液中不能确定的离子是Fe3+,则硫酸根离子的物质的量大于0.075 mol,生成沉淀C硫酸钡的物质的量大于0.075 mol;故答案为:BaSO4;≥0.075 mol。


科目:高中化学 来源: 题型:
【题目】某密闭容器中充入等物质的量的A和B,一定温度下发生反应A(g)+xB(g) ![]() 2C(g),达到平衡后,在不同的时间段内反应物的浓度随时间的变化如图甲所示,正逆反应速率随时间的变化如图乙所示,下列说法中正确的是( )
2C(g),达到平衡后,在不同的时间段内反应物的浓度随时间的变化如图甲所示,正逆反应速率随时间的变化如图乙所示,下列说法中正确的是( )

A.30~40 min间该反应使用了催化剂
B.化学方程式中的x=1,正反应为吸热反应
C.30 min时降低温度,40 min时升高温度
D.8 min前A的平均反应速率为0.08 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,pH均为2的两种一元酸HA和HB各1mL,分别加水稀释,pH随溶液体积的变化曲线如下图所示。下列说法正确的是( )

A.HA的酸性比HB的酸性弱
B.a点溶液的导电性比c点溶液的导电性弱
C.若两溶液无限稀释,则它们的c(H+)相等
D.对a、b两点溶液同时升高温度,则![]() 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定碱式碳酸钴[COx(OH)y(CO3)z]的化学组成,研究性学习小组的同学设计了如图所示的装置进行实验探究。已知:碱式碳酸钴受热时可分解生成三种氧化物。
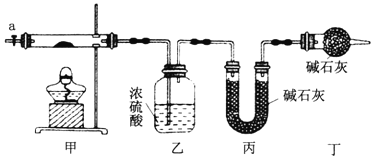
(1)按如图所示装置组装好仪器,并___________;称取3.65g样品置于硬质玻璃管内,加热,当乙装置中_______(填实验现象),停止加热;打开活塞a,缓缓通入空气数分钟,通入空气的目的是__________。
(2)某同学认为上述实验中存在一个缺陷,该缺陷是_________。
(3)通过正确实验测得乙、丙装置增重分别为0.36g、0.88g,则该碱式碳酸钴的化学式为__________。
(4)CoCl2·6H2O常用作多彩水泥的添加剂。以含钴废料(含少量Fe、Al等杂质)制取COCl2·6H2O的一种工艺如下:
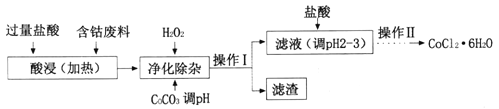
已知:25℃时
沉淀物 | Fe(OH)3 | Fe(OH)2 | CO(OH)2 | Al(OH)3 |
开始沉淀(pH) | 2.3 | 7.5 | 7.6 | 3.4 |
完全沉淀(pH) | 4.1 | 9.7 | 9.2 | 5.2 |
①净化除杂时,加入H2O2发生反应的离子方程式为______________;
②加入CoCO3调pH为5.2~7.6,则操作I获得的滤渣成分为_________;
③加盐酸调整pH为2~3的目的为___________;
④操作Ⅱ过程为蒸发浓缩、冷却结晶、过滤。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备四水甲酸铜[Cu(HCOO)24H2O]晶体实验步骤如下。
(1)碱式碳酸铜的制备:
a.步骤i是将一定量胆矾和碳酸氢钠固体一起放到研钵中研磨,其目的是______。
b.步骤ii是在搅拌下将固体混合物分多次缓慢加入热水中,反应温度控制在70℃—80℃,如果看到_____(写实验现象),说明温度过高。
c.相关的化学方程式______。
(2)四水甲酸铜晶体的制备:将碱式碳酸铜固体放入烧杯中,加入一定量热的蒸馏水,再逐滴加入甲酸至碱式碳酸铜恰好全部溶解,乘热过滤除去少量不溶性杂质,然后蒸发冷却过滤,在用少量无水乙醇洗涤晶体2—3次晾干,得到产品。
a.相关的化学方程式______。
b.趁热过滤中,必须趁热的原因是______。
c.用乙醇洗涤晶体的目的______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某合作学习小组讨论辨析下列说法,其中说法正确的数目为
①离子反应可能是复分解反应,但一定不是氧化还原反应②电解质在水中一定能导电,非电解质在水中一定不导电③CO2的水溶液可以导电,故 CO2是电解质④同温同压下,等质量的二氧化硫气体和二氧化碳气体密度比为 16:11,体积比为 11:16⑤某固体中加入稀盐酸,产生了无色气体,证明该固体中一定含有碳酸盐
A.1B.2C.3D.4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】玻璃钢可由酚醛树脂和玻璃纤维制成。
(1)酚醛树脂有苯酚和甲醛缩聚而成,反应有大量热放出,为防止温度过高,应向已有苯酚的反应釜中__加入甲醛,且反应釜应装有__装置;
(2)玻璃纤维由玻璃拉丝得到。普通玻璃是由石英砂、__和石灰石(或长石)高温熔融而成,主要反应的化学方程式为__;
(3)玻璃钢中玻璃纤维的作用是__;玻璃钢具有___等优异性能(写出亮点即可);
(4)下列处理废旧热固性酚醛塑料的做法合理的是__;
a.深埋 b.粉碎后用作树脂填料
c.用作燃料 d.用有机溶剂将其溶解,回收树脂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应SO2(g)+NO2(g)SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如右所示.由图可得出的正确结论是( )
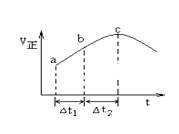
A.反应在c点达到平衡状态
B.反应物浓度:a点小于b点
C.反应物的总能量低于生成物的总能量
D.△t1=△t2时,SO2的转化率:a~b段小于b~c段
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com