
【题目】玻璃钢可由酚醛树脂和玻璃纤维制成。
(1)酚醛树脂有苯酚和甲醛缩聚而成,反应有大量热放出,为防止温度过高,应向已有苯酚的反应釜中__加入甲醛,且反应釜应装有__装置;
(2)玻璃纤维由玻璃拉丝得到。普通玻璃是由石英砂、__和石灰石(或长石)高温熔融而成,主要反应的化学方程式为__;
(3)玻璃钢中玻璃纤维的作用是__;玻璃钢具有___等优异性能(写出亮点即可);
(4)下列处理废旧热固性酚醛塑料的做法合理的是__;
a.深埋 b.粉碎后用作树脂填料
c.用作燃料 d.用有机溶剂将其溶解,回收树脂
【答案】间歇性 散热 纯碱 Na2CO3+SiO2![]() Na2SiO3+CO2↑、CaCO3+SiO2
Na2SiO3+CO2↑、CaCO3+SiO2![]() CaSiO3+CO2↑ 增强体 强度高、质量轻(或耐腐蚀、抗冲击、绝缘性能好等 bc
CaSiO3+CO2↑ 增强体 强度高、质量轻(或耐腐蚀、抗冲击、绝缘性能好等 bc
【解析】
(1)根据反应物投入的物质的量越多,放出的热量越高进行分析;
(2)根据生产玻璃所用的原料以及发生的反应原理进行回答;
(3)根据复合材料和增强体的构成情况以及玻璃钢的性能回答问题;
(4)根据废旧的合成材料可再生利用的知识来分析。
(1)苯酚和甲醛发生缩聚反应,反应有大量热量放出,为防止温度过高,应向已有苯酚的反应釜中间歇地加入甲醛,并装有散热装置;
(2)生产玻璃的原料为石灰石、石英砂和纯碱,反应原理为:Na2CO3+SiO2![]() Na2SiO3+CO2↑、CaCO3+SiO2
Na2SiO3+CO2↑、CaCO3+SiO2![]() CaSiO3+CO2↑;
CaSiO3+CO2↑;
(3)玻璃钢是将玻璃纤维和高分子材料复合而成的复合材料,其中玻璃纤维的作用是增强体,合成材料是基体,他的优点是强度高,质量轻,耐腐蚀,抗冲击,绝缘性能好等;
(4)废旧合成材料的再生利用有三条途径:①通过再生和改性,重新做成多种有用的材料和制品;②采用热裂解或化学方法使其分解,用于制备多种化工原料;③将废旧的聚合物作为燃料回收利用热能,塑料深埋很久都不会腐烂,造成白色污染,酚醛塑料不能溶于有机溶剂,因此合理的是bc。


科目:高中化学 来源: 题型:
【题目】某小分子抗癌药物的分子结构如图所示,下列说法正确的是

A. 1mol该有机物最多可以和5mol NaOH反应
B. 该有机物容易发生加成、取代、中和、消去等反应
C. 该有机物遇FeCl3溶液不变色,但可使酸性KMnO4溶液褪色
D. 1mol该有机物与浓溴水反应,最多消耗3mol Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某pH =1的溶液X,其中可能含有Al3+、Fe2+、Fe3+、Ba2+、NH4+、CO32-、SO42-、SiO32-、NO3-中的一种或几种,取500 mL该溶液进行实验,其现象及转化如图所示。
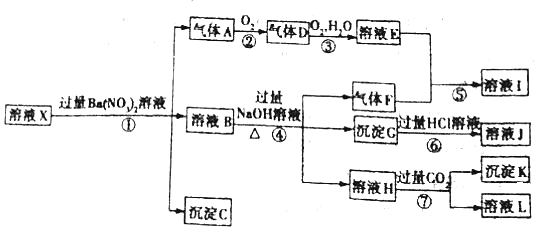
已知:反应过程中有一种气体是红棕色。请回答下列问题:
(1)仅由强酸性条件便可判断溶液X中一定不存在的离子有______。
(2)溶液X中,关于NO3-的判断一定正确的是______![]() 填字母
填字母![]() 。
。
a.一定有
b.一定没有
c.可能有
(3)反应①中产生气体A的离子方程式为______。
(4)反应⑦中生成沉淀K的离子方程式为______。
(5)溶液X中不能确定的离子是______。
(6)若实验测定A、F、K均为0.01 mol,试确定沉淀C是______,其物质的量范围是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=2的两种一元酸x和y,体积均为100 mL,稀释过程中pH与溶液体积的关系如下图所示。分别滴加NaOH溶液(c=0.1 mol·L-1)至pH=7。消耗NaOH溶液的体积为Vx、Vy则( )
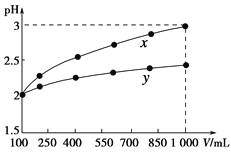
A.x为弱酸,Vx<VyB.x为强酸,Vx>Vy
C.y为弱酸,Vx<VyD.y为强酸,Vx>Vy
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香草醛是一种食品添加剂,可由愈创木酚作原料合成,合成路线如下:
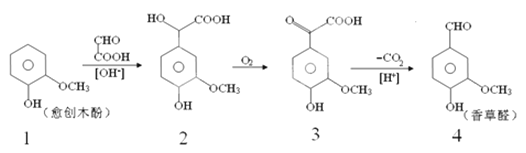
下列说法正确的是( )
A. 反应1→2属于加成反应,且生成的化合物2具有一个手性碳原子
B. 化合物2在一定条件下可发生消去反应
C. 检验制得的香草醛中是否混有化合物3,可用氯化铁溶液
D. 等物质的量四种化合物分别与足量NaOH反应,消耗NaOH物质的量之比为1:3:2:4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在如图所示装置中进行氨的催化氧化实验:往三颈瓶内的浓氨水中不断通入空气,将红热的铂丝插入瓶中并接近液面。反应过程中,可观察到瓶中有红棕色气体产生,铂丝始终保持红热。下列有关说法错误的是( )

A. 反应后溶液中含有NO3-
B. 反应后溶液中c(H+)增大
C. 实验过程中有化合反应发生
D. 实验过程中NH3H2O的电离常数不可能发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下述实验方案能达到实验目的的是 ( )
编号 | A | B | C | D |
实验 |
|
|
|
|
实验 | 验证铁钉发生 | 验证Fe电极被保护 | 验证乙炔的还原性 | 验证甲烷与氯气发生 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A卷题.电子工业常用FeCl3溶液腐蚀绝缘板上的铜箔,制造印刷电路板。从腐蚀废液(主要含FeCl3、FeCl2、CuCl2 )中回收铜,并重新获得FeCl3溶液。废液处理流程如下:
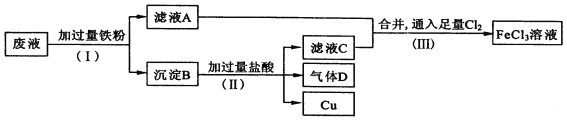
(1)步骤(Ⅰ)中分离溶液和沉淀的操作名称是____________________;
(2)沉淀B中主要含有铁和__________,气体D是_________________;
(3)写出步骤(Ⅲ)中生成FeCl3的化学方程式_____________________________;
(4)取少量最终所得溶液滴加____________(填“KSCN溶液”或“稀硫酸”),溶液呈红色,证明有Fe3+存在;写出该反应的离子方程式___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com