
【题目】下述实验方案能达到实验目的的是 ( )
编号 | A | B | C | D |
实验 |
|
|
|
|
实验 | 验证铁钉发生 | 验证Fe电极被保护 | 验证乙炔的还原性 | 验证甲烷与氯气发生 |
A.AB.BC.CD.D
 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
【题目】为测定碱式碳酸钴[COx(OH)y(CO3)z]的化学组成,研究性学习小组的同学设计了如图所示的装置进行实验探究。已知:碱式碳酸钴受热时可分解生成三种氧化物。
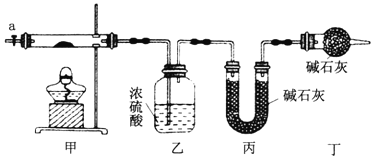
(1)按如图所示装置组装好仪器,并___________;称取3.65g样品置于硬质玻璃管内,加热,当乙装置中_______(填实验现象),停止加热;打开活塞a,缓缓通入空气数分钟,通入空气的目的是__________。
(2)某同学认为上述实验中存在一个缺陷,该缺陷是_________。
(3)通过正确实验测得乙、丙装置增重分别为0.36g、0.88g,则该碱式碳酸钴的化学式为__________。
(4)CoCl2·6H2O常用作多彩水泥的添加剂。以含钴废料(含少量Fe、Al等杂质)制取COCl2·6H2O的一种工艺如下:
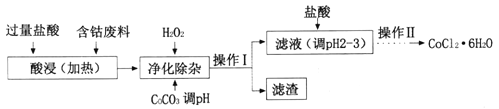
已知:25℃时
沉淀物 | Fe(OH)3 | Fe(OH)2 | CO(OH)2 | Al(OH)3 |
开始沉淀(pH) | 2.3 | 7.5 | 7.6 | 3.4 |
完全沉淀(pH) | 4.1 | 9.7 | 9.2 | 5.2 |
①净化除杂时,加入H2O2发生反应的离子方程式为______________;
②加入CoCO3调pH为5.2~7.6,则操作I获得的滤渣成分为_________;
③加盐酸调整pH为2~3的目的为___________;
④操作Ⅱ过程为蒸发浓缩、冷却结晶、过滤。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】玻璃钢可由酚醛树脂和玻璃纤维制成。
(1)酚醛树脂有苯酚和甲醛缩聚而成,反应有大量热放出,为防止温度过高,应向已有苯酚的反应釜中__加入甲醛,且反应釜应装有__装置;
(2)玻璃纤维由玻璃拉丝得到。普通玻璃是由石英砂、__和石灰石(或长石)高温熔融而成,主要反应的化学方程式为__;
(3)玻璃钢中玻璃纤维的作用是__;玻璃钢具有___等优异性能(写出亮点即可);
(4)下列处理废旧热固性酚醛塑料的做法合理的是__;
a.深埋 b.粉碎后用作树脂填料
c.用作燃料 d.用有机溶剂将其溶解,回收树脂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知锌及其化合物的性质与铝及其化合物相似。如图横坐标为溶液的pH,纵坐标为Zn2+或[Zn(OH)4]2-的物质的量浓度的对数。下列说法中错误的是( )

A.在该温度下,Zn(OH)2的溶度积(Ksp)为1×10-17
B.往1.0 L 1.0 mol·L-1 ZnCl2溶液中加入NaOH固体至pH=6,没有Zn(OH)2沉淀生成
C.往ZnCl2溶液中加入足量的氢氧化钠溶液,反应的离子方程式为Zn2++4OH-=[Zn(OH)4]2-
D.某废液中含Zn2+,为提取Zn2+可以控制溶液中pH的范围为8.0~12.0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时在10 mL 0.1mol·L—1Na2CO3溶液中逐滴加入0.1 mol·L—1HCl溶液20 mL,溶液中部分含碳微粒的物质的量随溶液pH的变化如图所示。下列说法不正确的是

A.HCl溶液滴加一半时,溶液pH>7
B.当溶液的pH=8时,溶液中NaHCO3的物质的量浓度为0.1mol·L—1
C.0.1 mol·L—1Na2CO3溶液中c(Na+)+c(H+)=c(OH—)+2c(CO32—)+c(HCO3—)
D.在M点:c(Na+)>c(CO32—)=c(HCO3—)>c(OH—)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
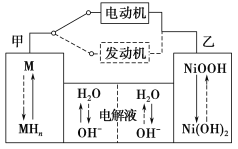
【题目】第三代混合动力车,可以用电动机、内燃机或二者结合推动车辆汽车上坡或加速时,电动机提供推动力,降低汽油的消耗;在刹车或下坡时,电池处于充电状态。
(1)混合动力车的内燃机以汽油为燃料,汽油(以辛烷C8H18计)和氧气充分反应,生成1 mol水蒸气放热569.1 kJ。则该反应的热化学方程式为_____________。
(2)混合动力车目前一般使用镍氢电池,该电池中镍的化合物为正极,储氢金属(以M表示)为负极,碱液(主要为KOH)为电解质溶液。镍氢电池充放电原理示意如图,其总反应式为H2+2NiOOH ![]() 2Ni(OH)2。根据所给信息判断,混合动力车上坡或加速时,乙电极周围溶液的pH_____(填“增大”、“减小”或“不变”),该电极的电极反应式为___________。
2Ni(OH)2。根据所给信息判断,混合动力车上坡或加速时,乙电极周围溶液的pH_____(填“增大”、“减小”或“不变”),该电极的电极反应式为___________。
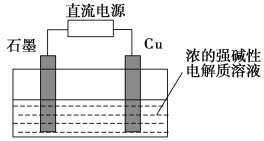
(3)Cu2O是一种半导体材料,可通过如图所示的电解装置制取,电解总反应式为2Cu+H2O![]() Cu2O+H2↑,阴极的电极反应式是____________________。用镍氢电池作为电源进行电解,当电池中有1 mol H2被消耗时,Cu2O的理论产量为________g。
Cu2O+H2↑,阴极的电极反应式是____________________。用镍氢电池作为电源进行电解,当电池中有1 mol H2被消耗时,Cu2O的理论产量为________g。
(4)远洋轮船的钢铁船体在海水中易发生电化学腐蚀。为防止这种腐蚀,通常把船体与浸在海水里的Zn块相连,或与像铅酸蓄电池这样的直流电源的________(填“正”或“负”)极相连。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应SO2(g)+NO2(g)SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如右所示.由图可得出的正确结论是( )
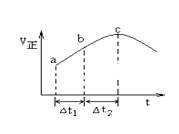
A.反应在c点达到平衡状态
B.反应物浓度:a点小于b点
C.反应物的总能量低于生成物的总能量
D.△t1=△t2时,SO2的转化率:a~b段小于b~c段
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)聚四氟乙烯商品名称为“特氟龙”,可做不粘锅涂层。它是一种准晶体,该晶体是一种无平移周期序、但有严格准周期位置序的独特晶体。可通过___方法区分晶体、准晶体和非晶体。
(2)下列氮原子的电子排布图表示的状态中,能量由低到高的顺序是___(填字母代号)。
A.![]() B.
B.![]()
C.![]() D.
D.![]()
(3)某种铀氮化物的晶体结构是NaCl型。NaCl的Bom-Haber循环如图所示。已知:元素的一个气态原子获得电子成为气态阴离子时所放出的能量称为电子亲和能。下列有关说法正确的是__(填标号)。
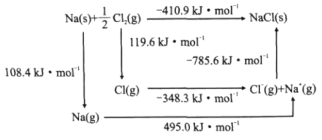
a.Cl-Cl键的键能为119.6kJ/mol b.Na的第一电离能为603.4kJ/mol
c.NaCl的晶格能为785.6kJ/mol d.Cl的第一电子亲和能为348.3kJ/mol
(4)配合物[Cu(En)2]SO4的名称是硫酸二乙二胺合铜(Ⅱ),是铜的一种重要化合物。其中En 是乙二胺(H2N-CH2-CH2-NH2)的简写。
①该配合物中含有化学键有___(填字母编号)。
A.离子键 B.极性共价键 C.非极性共价键 D.配位键 E.金属键
②配体乙二胺分子中氮原子、碳原子轨道的杂化类型分别为___、___。
③乙二胺和三甲胺[N(CH3)3]均属于胺,且相对分子质量相近,但乙二胺比三甲胺的沸点高得多,原因是___。
④乙二胺(H2NCH2CH2NH2)是一种有机化合物,乙二胺能与Mg2+、Cu2+等金属离子形成稳定环状离子,其原因是___,其中与乙二胺形成的化合物稳定性相对较高的是___(填“Mg2+”或“Cu2+”)。
⑤与氨气互为等电子体的阳离子为___,与S位于同一周期,且第一电离能小于S的非金属元素符号为___。
(5)①金属钛的原子堆积方式如图1所示,则金属钛晶胞俯视图为____。

A. B.
B.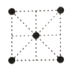 C.
C. D.
D.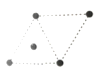
②某砷镍合金的晶胞如图所示,设阿伏加德罗常数的值为NA,该晶体的密度ρ=__g·cm-3。
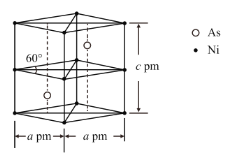
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,取浓度均为0.1 mol·L1的醋酸溶液和氨水各20 mL,分别用0.1 mol·L1 氢氧化钠溶液和0.1 mol·L1盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示。下列说法正确的是
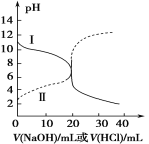
A.曲线I,滴加10 mL溶液时:c(NH4+)+c(H+)=c(OH-)+c(NH3·H2O)
B.曲线I,滴加20 mL溶液时:两溶液恰好完全反应,此时溶液的pH<7
C.曲线II,滴加溶液体积在10~20 mL之间时存在:c(NH4+)=c(Cl-)>c(OH-)=c(H+)
D.曲线II,滴加30 mL溶液时:c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com