
【题目】某同学用如图装置(固定、加热仪器和橡胶管略)进行有关氨气制取的实验探究,回答下列问题。
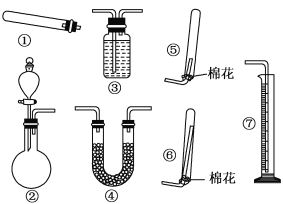
(1)若用装置①制取NH3,其反应的化学方程式为_________;若要测定生成的NH3的体积,则必须选择的装置是________(填装置序号)。
(2)若用装置②制取并收集干燥的NH3,烧瓶内装的试剂可以是______,收集装置应选择________(填装置序号)。
(3)下列气体中,可用碱石灰干燥的是________(填字母)。
A.H2 B.Cl2 C.SO2 D.NH3
【答案】2NH4Cl+Ca(OH)2![]() 2NH3↑+CaCl2+2H2O ③⑦ CaO或NaOH或碱石灰 ⑥ AD
2NH3↑+CaCl2+2H2O ③⑦ CaO或NaOH或碱石灰 ⑥ AD
【解析】
(1)装置①适用于固体加热制气体,实验室中可加热氯化铵和氢氧化钙固体混合物制取氨气,化学方程式为2NH4Cl+Ca(OH)2![]() 2NH3↑+CaCl2+2H2O;氨气极易溶于水,无法排水收集,但可以在装置③盛放不能溶解氨气的液体,将生成的氨气短进长出导入到装置③中,将装置中液体排出到量筒中,通过液体的体积确定生成的氨气体积,所以选③⑦;
2NH3↑+CaCl2+2H2O;氨气极易溶于水,无法排水收集,但可以在装置③盛放不能溶解氨气的液体,将生成的氨气短进长出导入到装置③中,将装置中液体排出到量筒中,通过液体的体积确定生成的氨气体积,所以选③⑦;
(2)装置②适用于固体与液体常温下制气体,氨气为碱性气体,可用CaO、NaOH、碱石灰等碱性物质与浓氨水作用制氨气;氨气极易溶于水,氨气密度比空气小,可用向下排空气法收集,将导管插入到倒置试管底部,所以选用⑥;
(3)氢气和氨气均不与碱石灰反应,可以用碱石灰干燥,氯气、SO2会和碱石灰发生反应,不能用碱石灰干燥,所以选AD。


 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:
【题目】[化学-选修3:物质结构与性质]固体电解质有广泛的用途。研究发现,晶体中有特殊结构为离子(如Li+)提供快速迁移的通道或者有“点缺陷”。都能使其具有导电潜力,比如:图(a)所示的锂超离子导体Li3SBF4和图(b)所示的有“点缺陷”的NaCl。
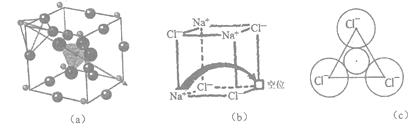
根据所学知识回答下列问题:
(1)在变化“Cl+e-→Cl-”过程中,所得电子填充在基态 Cl的________能级,此过程会________ (填“吸收”或“释放”)能量。
(2)BF4-中B的杂化形式为________________,其等电子体为___________(任写一种)。与其VSEPR模型相同,且有l对孤电子对的相对分子质量最小的分子是___________。
(3)图(a)所示晶胞中Li+位于_____位置;若将晶体中BF4-换成F-,导电能力会明显降低,原因是______________________________。
(4)图(6)中,若缺陷处填充了Na+,则它__________(填“是”或“不是”) NaCl的晶胞,在NaCl晶体中,Na+填充在Cl-堆积而成的__________面体空隙中。
(5)有人认为:高温下有“点缺陷”的NaCl晶伙导电性增照是由于Na+迁移到另一空位而造成。其中Na+经过一个由3个Cl-组成的最小三角形窗孔(如图c所示)。已知晶胞参数a=564 pm,r(Na+)=116pm, r(Cl-)=167 pm,通过计算三角形窗孔半径,判断该认识是否正确。__________。(已知:![]() ≈1.414,
≈1.414,![]() ≈1.732)
≈1.732)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对滴有酚酞试液的下列溶液,操作后颜色变深的是
A. 明矾溶液加热 B. CH3COONa溶液加热
C. 氨水中加入少量NH4Cl固体 D. 小苏打溶液中加入少量NaCl固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,某一元酸(HB)的盐NaB的水溶液呈碱性,下列叙述正确的是( )
A.HB的电离方程式为HB===H++B-
B.NaB溶液中:c(Na+)>c(B-)>c(H+)>c(OH-)
C.NaB溶液中:c(Na+)+c(H+)=c(HB)+c(B-)
D.0.1 mol/L NaB溶液中水电离的OH-浓度大于10-7 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盐酸、醋酸和碳酸氢钠是生活中常见的物质。下列表述正确的是( )
A. 在NaHCO3溶液中加入与其等物质的量的NaOH,溶液中的阴离子只有CO![]() 和OH-
和OH-
B. NaHCO3溶液中:c (H+)+ c (H2CO3)=c(OH-)
C. 10 mL0.10 mol·L-1CH3COOH溶液加入等物质的量的NaOH后,溶液中离子的浓度由大到小的顺序是:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D. 中和体积与pH都相同的HCl溶液和CH3COOH溶液所消耗的NaOH物质的量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:
实验编号 | 起始浓度/(mol·L-1) | 反应后溶液的pH | |
c(HA) | c(KOH) | ||
① | 0.1 | 0.1 | 9 |
② | x | 0.2 | 7 |
下列判断不正确的是
A.实验①反应后的溶液中:c(K+)>c(A-)>c(OH-)>c(H+)
B.实验①反应后的溶液中:c(OH-)=c(K+)-c(A-)=![]() mol/L
mol/L
C.实验②反应后的溶液中:c(A-)+c(HA)>0.1mol·L-1
D.实验②反应后的溶液中:c(K+)=c(A-)>c(OH-) =c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=2的A、B两种酸溶液各1 mL,分别加水稀释到1 000 mL,其中pH与溶液体积V的关系如图所示,下列说法正确的是

A. 稀释前,A、B两酸溶液的物质的量浓度一定相等
B. 稀释后,A酸溶液的酸性比B酸溶液强
C. a=5时,A是强酸,B是弱酸
D. 稀释导致B酸的电离程度减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.常温下,将某一元酸HA(甲、乙、丙、丁代表不同的一元酸)和NaOH溶液等体积混合,两种溶液的物质的量的浓度和混合液的pH如下表所示:
实验编号 | HA的物质的量浓度(mol·L-1) | NaOH的物质的量浓度(mol·L-1) | 混合后溶液的pH |
甲 | 0.1 | 0.1 | pH=a |
乙 | 0.12 | 0.1 | pH=7 |
丙 | 0.2 | 0.1 | pH>7 |
丁 | 0.1 | 0.1 | pH=10 |
(1)从甲组情况分析,如何判断HA是强酸还弱酸? 。
(2)乙组混合溶液中离子浓度c(A-)和c(Na+)的大小关系是 。
A.前者大 B.后者大 C.二者相等 D.无法判断
(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是 。
(4)分析丁组实验数据,写出该混合溶液中下列算式的精确结果(列式):c(Na+)-c(A-)= mol/L。
Ⅱ.某二元酸(分子式用H2B表示)在水中的电离方程式是:H2B=H++HB-;HB-![]() H++B2-
H++B2-
回答下列问题:
(5)在0.1 mol/L的Na2B溶液中,下列粒子浓度关系式正确的是 。
A.c(B2-)+c(HB-)=0.1mol/L
B.c(B2-)+c(HB-)+c(H2B)=0.1mol/L
C.c(OH-)=c(H+)+c(HB-)
D.c(Na+)+c(OH-)=c(H+)+c(HB-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学原理在防止金属腐蚀、能量转换、物质合成等方面应用广泛。

(1)图1中,为了减缓海水对钢闸门A的腐蚀,材料B可以选择__________(填字母)。
a.碳棒b.锌板c.铜板

(2)镁燃料电池在可移动电子设备电源和备用电源等方面应用前景广阔。图2为“镁—次氯酸盐”燃料电池原理示意图,电极为镁合金和铂合金。
①E为该燃料电池的________(填“正”或“负”)极。F电极上的电极反应式为____________________________________________________________。
②镁燃料电池负极容易发生自腐蚀产生氢气,使负极利用率降低,用化学用语解释其原因_________________________________________________________________________。

(3)乙醛酸(HOOC-CHO)是有机合成的重要中间体。工业上用“双极室成对电解法”生产乙醛酸,原理如图3所示,该装置中阴、阳两极为惰性电极,两极室均可产生乙醛酸,其中乙二醛与M电极的产物反应生成乙醛酸。
①N电极上的电极反应式为_______________________________________________________。
②若有2mol H+通过质子交换膜,并完全参与了反应,则该装置中生成的乙醛酸为________mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com