
【题目】硫代硫酸钠晶体(![]() )又名大苏打、海波,易溶于水,难溶于乙醇,在中性或碱性溶液中稳定,广泛应用于日常生产生活中。回答下列问题:
)又名大苏打、海波,易溶于水,难溶于乙醇,在中性或碱性溶液中稳定,广泛应用于日常生产生活中。回答下列问题:
I.硫代硫酸钠的结构与性质
(1)![]() 的结构式如图所示,其中
的结构式如图所示,其中![]() 的化合价为____。
的化合价为____。

(2)![]() 在酸性条件下性质不稳定。取少量
在酸性条件下性质不稳定。取少量![]() 溶液于试管中,滴入少量6
溶液于试管中,滴入少量6![]() 的盐酸,发生反应的离子方程式为____。
的盐酸,发生反应的离子方程式为____。
II.硫代硫酸钠晶体的制备
(3)在圆底烧瓶中加入12g![]() 、60mL水、4g硫黄,加热1小时后,趁热减压过滤;再用乙醇洗涤晶体、干燥后得到
、60mL水、4g硫黄,加热1小时后,趁热减压过滤;再用乙醇洗涤晶体、干燥后得到![]() 晶体。
晶体。
①写出制备![]() 的化学方程式:____。
的化学方程式:____。
②用乙醇洗涤晶体的原因是________。
III.![]() 晶体含量的测定
晶体含量的测定
(4)准确称取1.5g产品,加入20mL煮沸并冷却后的水使其完全溶解,以淀粉作指示剂,用0.1000 ![]() 碘的标准溶液滴定。已知:
碘的标准溶液滴定。已知:![]() (无色)+
(无色)+![]() ,杂质与碘水不反应。
,杂质与碘水不反应。
①碘的标准溶液应盛放在____(填“酸式”或“碱式”)滴定管中。
②判断滴定终点的现象为____。
③第一次滴定开始和结束时,滴定管中的液面如图所示,则第一次消耗碘的标准溶液的体积为____mL。

④重复上述操作两次,记录数据如下表,则产品中的含量为____%(结果保留1位小数)。
滴定次数 | 滴定前读数/mL | 滴定后读数/mL |
第二次 | 1.56 | 30.30 |
第三次 | 0.22 | 26.31 |
【答案】+4 ![]()
![]()
![]() 易溶于水,难溶于乙醇,减小
易溶于水,难溶于乙醇,减小![]() 的溶解损失 酸式 当滴入最后一滴碘的标准溶液时,溶液由无色变为蓝色,且半分钟内不褪色 26.10 86.3
的溶解损失 酸式 当滴入最后一滴碘的标准溶液时,溶液由无色变为蓝色,且半分钟内不褪色 26.10 86.3
【解析】
(1)根据![]() 的结构式可知硫硫键是非极性键,硫氧之间氧电负性更强,氧显-2价,
的结构式可知硫硫键是非极性键,硫氧之间氧电负性更强,氧显-2价,![]() 显-2价,
显-2价,![]() 的化合价为+4价。
的化合价为+4价。
(2)由已知信息![]() 在中性或碱性溶液中稳定,在酸性溶液中发生自身歧化反应,离子方程式为
在中性或碱性溶液中稳定,在酸性溶液中发生自身歧化反应,离子方程式为![]()
![]() 。
。
(3)①制备![]() 的化学方程式为
的化学方程式为![]() 。②由已知信息可知,用乙醇洗涤晶体的原因是
。②由已知信息可知,用乙醇洗涤晶体的原因是![]() 易溶于水,难溶于乙醇,减小
易溶于水,难溶于乙醇,减小![]() 的溶解损失。
的溶解损失。
(4)①碘有强氧化性,应盛放在酸式滴定管中。②淀粉遇碘变蓝,判断滴定终点的现象为当滴入最后一滴碘的标准溶液时,溶液由无色变为蓝色,且半分钟内不褪色。③由图可知,第一次滴定开始读数为0.00mL,结束读数为26.10mL,则第一次消耗碘的标准溶液的体积为26.10mL。④碘的标准溶液的体积第一次测量数据为26.10mL,第二次测量数据为28.74mL,第三次测量数据为26.09mL,第二次测量数据与其他两次相差2mL以上,应舍去,第一次和第三次数据的平均值为26.10mL。根据反应![]() ,可知2
,可知2![]() ,根据关系式法,列式
,根据关系式法,列式![]() 100
100![]() 。
。


科目:高中化学 来源: 题型:
【题目】25°C向![]() 中滴加
中滴加![]() 过程中,
过程中,![]() 变化如图所示。
变化如图所示。

(1)A点溶液![]() ,用化学用语解释原因:_________________。
,用化学用语解释原因:_________________。
(2)下列有关B点溶液的说法正确的是_______________(填字母序号)。
a. 溶质为:![]()
b. 微粒浓度满足:![]()
c. 微粒浓度满足:![]()
(3)![]() 两点水的电离程度:
两点水的电离程度:![]() ______
______![]() (填“
(填“![]() ”、“
”、“ ![]() ”或“
”或“![]() ”)。
”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、R、Q、M是六种原子序数依次增大的短周期主族元素,X是原子半径最小的元素,Y的气态氢化物能使湿润的红色石蕊试纸变蓝,Z的单质是空气的主要成分之一,R、Q、M三种元素的最高价氧化物对应的水化物相互之间均可反应,M的单质是黄绿色气体。请回答下列问题:
(1)Z和M的非金属性强弱Z_________M(填“<”“>”或“=”)。
(2)Z、Q、M简单离子半径由大到小的顺序为__________________(用离子符号表示)。
(3)X和Z两元素形成的原子个数比为1∶1的化合物电子式为___________。
(4)Y元素的气态氢化物与其最高价氧化物对应的水化物反应的化学方程式为______________,所生成的物质水溶液中离子浓度由大到小的顺序为_______________。
(5)![]() 是一种高效安全的杀菌消毒剂,它能将电镀废水中的
是一种高效安全的杀菌消毒剂,它能将电镀废水中的![]() 氧化为两种无毒的气体,自身还原成最低价的简单离子,写出该反应的离子方程式___________________________。
氧化为两种无毒的气体,自身还原成最低价的简单离子,写出该反应的离子方程式___________________________。
(6)用电解法可制备![]() ,电解总反应为
,电解总反应为![]() 。已知阳极产物为
。已知阳极产物为![]() ,该物质在水中水解生成
,该物质在水中水解生成![]() 和
和![]() ,则该电极生成
,则该电极生成![]() 的电极反应为________________。
的电极反应为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是原子序数依次增大的短周期元素。m、n、p是由这些元素组成的二元化合物,r是元素Y的常见单质能使带火星的木条复燃,q的水溶液呈碱性。0.0l mol·L-l s溶液的pH为12,q、s的焰色反应均呈黄色。
上述物质的转化关系如图所示。下列说法正确的是
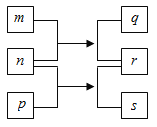
A. 原子半径:w<x<Y<z
B. 通常状况下,X的氢化物可能呈气态、液态或固态
C. Y的氢化物的沸点比Z的氧物的沸点高
D. 由W、X、Y、Z四种元素只能组成一种化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸(分子式为 H2C2O4,沸点:150℃)是生物体的一种代谢产物,广泛分布于植物、动 物和真菌体中。下列有关判断不正确的是
A.草酸的摩尔质量是 90 g/mol
B.草酸中碳元素的质量分数为 13.3%
C.1 mol 草酸中约含有 6.02×1023 个分子
D.1 mol 草酸在标准状况下的体积约为 22.4 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某软锰矿的主要成分为![]() ,还含有
,还含有![]() 等杂质,用该软锰矿制备
等杂质,用该软锰矿制备![]() 的流程图如图:
的流程图如图:
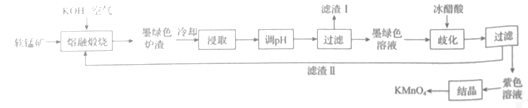
已知:I.![]() 固体和溶液均为黑绿色;
固体和溶液均为黑绿色;
II.![]() 溶液中存在以下平衡:
溶液中存在以下平衡:![]()
回答下列问题:
(1)“熔融煅烧”时,![]() 参与反应的化学方程式为_____。
参与反应的化学方程式为_____。
(2)“浸取“过程中,为加快浸取速率。可以采取的措施有____(写出两点)。向浸取液中通入![]() 调节其pH,经“过滤”得滤渣I,滤渣I的成分是____(填化学式)。
调节其pH,经“过滤”得滤渣I,滤渣I的成分是____(填化学式)。
(3)“歧化”时,加入冰醋酸的目的是____。“歧化”时,下列酸可以用来代替冰醋酸的有____(填字母)。
a.乙二酸 b.亚硫酸 c.氢溴酸 d.稀硫酸
(4)“结晶”时,当___时,停止加热,自然冷却,抽滤后即可获得紫黑色![]() 晶体。
晶体。
(5)已知![]() 能与热的硫酸酸化的
能与热的硫酸酸化的![]() 反应生成
反应生成![]() 和
和![]() 。取上述制得的
。取上述制得的![]() 产品7.0g,恰好与13.4g
产品7.0g,恰好与13.4g![]() 完全反应,则
完全反应,则![]() 的纯度为____%(结果保留1位小数)。
的纯度为____%(结果保留1位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】维生素 C(又名抗坏血酸,分子式为 C6H8O6)具有较强的还原性,放置在空气中易被氧化,其质量分数可通过在弱酸性溶液中用已知物质的量浓度的 I2 溶液进行测定。该反应 的化学方程式如下:C6H8O6+ I2 = C6H6O6 +2HI。现欲测定某样品中维生素 C 的质量分 数,具体的步骤及测得的数据如下:取10mL6mol/LCH3COOH(提供酸性环境),加入100 mL 蒸馏水,将溶液加热煮沸后放置冷却。精确称取 0.2000g 样品,溶解于上述冷却的 溶液中,立即用物质的量浓度为 0.05000 mol/L 的 I2 溶液进行反应,刚好完全反应时共消耗21.00 mL I2 溶液。
(1)CH3COOH 稀溶液要先经煮沸、冷却后才能使用,煮沸的是为了赶走溶液在溶液中的_____(填物质的化学式)
(2)样品中维生素 C 的质量分数为______。计算过程
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将a克Fe2O3、Al2O3样品溶解在过量的200mL pH=1的硫酸溶液中,然后向其中加入NaOH 溶液使Fe3+、Al3+刚好完全沉淀,用去NaOH 溶液100 mL,则NaOH 溶液的浓度为
A. 0.1 mol/LB. 0.2 mol/LC. 0.4 mol/LD. 0.8 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列反应:
①Fe+CuSO4=Cu+FeSO4
②CaO+H2O=Ca(OH)2
③Ba(OH)2+H2SO4 =BaSO4↓+2H2O
④Zn+2HCl=ZnCl2+H2↑
⑤2KClO3![]() 2KCl+3O2↑
2KCl+3O2↑
⑥CaCO3![]() CaO+CO2↑
CaO+CO2↑
⑦2CO+O2![]() 2CO2
2CO2
⑧SO42-+Ba2+=BaSO4↓
(1)反应①中,氧化剂是______________________。
(2)反应③的离子反应方程式为_________________________________________。
(3)写出一个符合⑧的化学反应方程式___________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com