
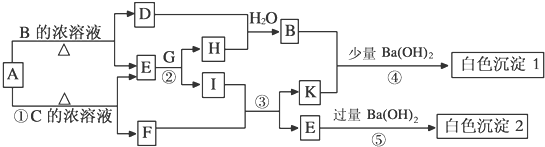
| ||
| ||


科目:高中化学 来源: 题型:
| A、甲苯、葡萄糖和乙醇均能使酸性高锰酸钾溶液褪色 |
| B、在鸡蛋白溶液中加入浓Na2SO4溶液,蛋白质发生变性 |
| C、乙酸乙酯、油脂与NaOH溶液反应均有醇生成 |
| D、分子式为C7H8O属于芳香族化合物的同分异构体有5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 目 的 | 分离方法 | 原 理 |
| A. | 分离溶于水的碘 | 乙醇萃取 | 碘在乙醇中的溶解度较大 |
| B. | 分离汽油和四氯化碳 | 分液 | 四氯化碳和汽油的密度不同 |
| C. | 除去KNO3固体中混杂的NaCl | 重结晶 | NaCl在水中的溶解度很大 |
| D. | 除去乙酸中的乙醚 | 蒸馏 | 乙酸与乙醚的沸点相差较大 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| H2O |
|
查看答案和解析>>
科目:高中化学 来源: 题型:
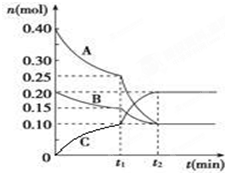 现将0.4mol A气体和0.2mol B气体充入10L的密闭容器中,在一定条件下使其发生反应生成气体C,其物质的量随时间的变化如图:
现将0.4mol A气体和0.2mol B气体充入10L的密闭容器中,在一定条件下使其发生反应生成气体C,其物质的量随时间的变化如图:查看答案和解析>>
科目:高中化学 来源: 题型:
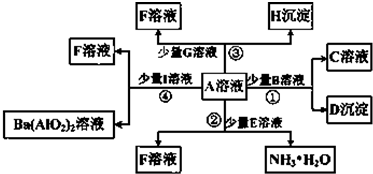
查看答案和解析>>
科目:高中化学 来源: 题型:
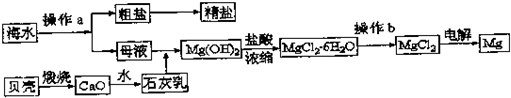
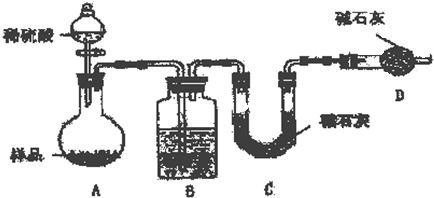
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com