
【题目】在______里或______下能够导电的化合物叫做电解质。电解质溶液之所以能够导电,是由于它们在溶液中发生了______,产生了______。电离时生成的______离子全部是______的化合物叫做酸;生成的______离子全部是______的化合物叫做碱。
 步步高达标卷系列答案
步步高达标卷系列答案科目:高中化学 来源: 题型:
【题目】据题目要求完成下列各题:
(1)少量的NaHCO3与Ca(OH)2反应的离子反应方程式____________。
(2)用双线桥标出方程式2KMnO4=K2MnO4 + MnO2 + O2中电子转移的方向和数目______________。
(3)用双线桥标出方程式6HCl + KClO3= KCl +3Cl2 +3H2O 中电子转移的方向和数目_______,并指出氧化产物与还原产物的物质的量的比___________。
(4)在MnO2+4HCl=MnCl2+Cl2+2H2O中氧化剂与还原剂的物质的量的比_______,当0.4molHCl被氧化时,则生成标准状况下的Cl2的体积为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.如图所示,一密闭容器被无摩擦、可滑动的两隔板a、b分成甲、乙两室;标准状况下,在乙室中充入NH30.4mol,甲室中充入HCl、N2的混合气体,静止时隔板位置如图所示。已知甲、乙两室中气体的质量之差为17.3g。
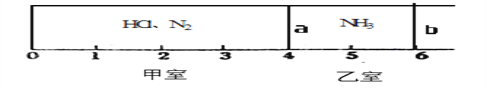
(1)甲室中HCl、N2的质量之比为__________________。
(2)将隔板a去掉,一段时间后,隔板b将稳定位于刻度“________”处(填数字,不考虑固体物质产生的压强),此时体系的平均相对分子质量为________。
Ⅱ.已知硫酸、氨水的密度与所加水的量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题:
溶质的物质的量浓度/molL-1 | 溶液的密度/gcm-3 | |
硫酸 | c1 | ρ1 |
氨水 | c2 | ρ2 |
(1)表中硫酸的质量分数为________(不写单位,用含c1、ρ1的代数式表示)。
(2)物质的量浓度为c1molL-1的硫酸与水等体积混合(混合后溶液的体积变化忽略不计),所得溶液的物质的量浓度为________molL-1。
(3)将物质的量浓度分别为c2molL-1和0.2c2molL-1的氨水等质量混合,所得溶液的物质的量浓度__________0.6c2molL-1(填“大于”、“小于”或“等于”)(设混合后溶液的体积变化忽略不计)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将有机物完全燃烧,生成CO2和H2O.将12g该有机物完全燃烧后的产物通过浓H2SO4 , 浓H2SO4增重14.4g,再通过碱石灰,碱石灰增重26.4g.该有机物分子式为( )
A.C4H10
B.C2H6O
C.C3H8O
D.C2H4O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学想通过利用如图所示装置(夹持装置略去)实验,探究SO2与Na2O2反应的产物 
请分析:
(1)Ⅰ.装置B的作用装置D的作用
Ⅱ.对C中固体产物提出如下假设:假设1:只有Na2SO3 假设2:只有Na2SO4 假设3:
(2)若按假设2进行,反应方程式为
(3)若Na2O2反应完全,为确定C中固体产物的成分,甲同学设计如下实验:得出结论:假设2成立
C中的固体配成溶液 ![]() 白色沉淀
白色沉淀 ![]() 沉淀不溶解
沉淀不溶解
该方案是否合理(填“是”或“否”),理由是
(4)若假设2成立,反应前后C管增加6.4g,请计算10g含有杂质的Na2O2固体中,Na2O2的质量分数为(所含的杂质不与SO2发生反应)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含A元素的一种单质是一种重要的半导体材料,含A元素的一种化合物C可用于制造高性能的现代通讯材料﹣﹣光导纤维,C与烧碱反应生成含A元素的化合物D.
(1)写出C与HF的化学方程式是 .
(2)将C与纯碱混合高温熔融时也发生化学反应生成D,同时还生成B的最高价氧化物E;将全部的E与全部的D在足量的水中混合后,又发生化学反应生成含A的化合物F.
①写出生成F的化学方程反应方程式: .
②要将纯碱高温熔化,下列坩埚中可选用的是 .
A、普通玻璃坩埚B、石英玻璃坩埚C、氧化铝坩埚D、铁坩埚
(3)100gC与石灰石的混合物充分反应后,生成的气体在标准状况下的体积为11.2L,100g混合物中石灰石的质量分数是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】榄香烯是一种新型的抗癌药,它的结构简式如图,有关说法正确的是( ) 
A.榄香烯的分子式为C15H20
B.榄香烯属于芳香烃
C.1 mol 榄香烯最多能和3 mol H2反应
D.榄香烯不能使酸性高锰酸钾溶液和溴的四氯化碳溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组用如图1装置进行实验,试回答下列问题. 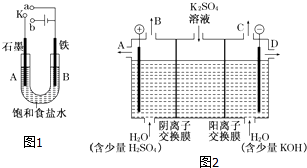
(1)若开始时开关K与a连接,则B极的电极反应式为 .
(2)若开始时开关K与b连接,则B极的电极反应式为 , 有关上述实验,下列说法正确的是(填序号) . ①溶液中Na+向A极移动
②从A极处逸出的气体能使湿润的KI淀粉试纸变蓝
③反应一段时间后通入适量HCl可恢复到电解前电解质的浓度
④若标准状况下B极产生2.24L气体,则溶液中转移0.1mol电子
(3)该小组同学认为,如果模拟工业上离子交换膜法制烧碱的方法,那么可以设想用如图2装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾. ①该电解槽的阳极反应式为 . 此时通过阴离子交换膜的离子数(填“大于”、“小于”或“等于”)通过阳离子交换膜的离子数.
②制得的氢氧化钾溶液从出口(填写“A”、“B”、“C”或“D”)导出.
③若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池,则电池正极的电极反应式为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com