
【题目】中药在世界医学界越来越受到关注。中药药剂砒霜(主要成分As2O3)可用于治疗急性白血病,为此,砷及其化合物的提取再次引起关注。
(1)As是33号元素,在元素周期表中的位置是________。
(2)N元素非金属性比As强,下列说法正确的是_______
①热稳定性:NH3<AsH3
②酸性:HNO3>H3AsO4
③原子半径:N<As
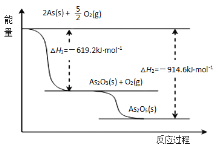
(3)请依据如图信息写出As2O5分解为As2O3的热化学方程式_______。
(4)查阅文献得知,可以从硫化砷(As2S3)废渣中提取As2O3,提取的工艺流程简图如图:

已知:As2S3不溶于水;As2O3微溶于水。
①As2S3、Na3AsS3中的硫元素均为-2价,碱浸过程中发生的反应______(填“是”或“不是”)氧化还原反应。
②过程Ⅲ的离子方程式为_______。
③过程Ⅲ得到纯净As2O3固体的系列操作包括_____、_____、_____。
④过程Ⅲ中,其它条件相同时仅改变溶液pH,发现酸性越强,As2O3的产率越高,可能的原因是_______。
【答案】第四周期VA族 ②③ As2O5(s)=As2O3(s)+O2(g) △H=+295.4kJ/mol 不是 2AsO43-+2SO2+2H+=As2O3↓+2SO42-+H2O 过滤 洗涤 干燥 酸性越强,物质的氧化性或者还原性可能增强;增加氢离子浓度,反应速率加快或者增加氢离子浓度,平衡正向移动促进反应的进行,有利于提高As2O3的产率
【解析】
(1)As的原子结构示意图为:![]() ,有4个电子层,最外层有5个电子,与N同族,故位于第四周期V A族;
,有4个电子层,最外层有5个电子,与N同族,故位于第四周期V A族;
(2)元素非金属性越强,对应氢化物的热稳定性越好,最高价氧化物对应水化物的酸性越强,As电子层数比N多2,非金属性N>As;
(3)根据盖斯定律可知,反应热与过程无关,只与始态、终态有关,由图可知:△H+|△H1|=|△H2|,据此计算;
(4)碱浸过程中没有元素化合价的变化,过程Ⅲ为溶液到固体,需要经过浓缩结晶,过滤,洗涤,烘干,发生反应的离子方程式为2AsO43-+2SO2+2H+=As2O3+2SO42-+H2O,酸性越强,物质的氧化性或者还原性可能增强;增加氢离子浓度平衡正向移动促进反应的进行,有利于提高As2O3的产率。
(1)As的原子结构示意图有4个电子层,最外层有5个电子,位于第四周期,V A族;
(2)元素非金属性越强,对应氢化物的热稳定性越好,最高价氧化物对应水化物的酸性越强,非金属性N>As,①NH3的热稳定性比AsH3好,②HNO3的酸性比H3AsO4强,③As电子层数比N多2,N的原子半径比As的原子半径小,故答案为:②③;
(3)根据盖斯定律可知,反应热与过程无关,只与始态、终态有关,由图可知:△H+|△H1|=|△H2|,△H=|△H2||△H1|==914.6kJ/mol619.2kJ/mol= +295.4kJ/mol,故该反应的热化学方程式为:As2O5(s)==As2O3(s)+O2(g) △H= +295.4kJ/mol;
(4)①碱浸过程中没有元素化合价的变化,故该反应不是氧化还原反应;
②过程Ⅲ发生反应的离子方程式为2AsO43-+2SO2+2H+=As2O3↓+2SO42-+H2O;
③过程Ⅲ为溶液到固体,需要经过浓缩结晶,过滤,洗涤,干燥;
④酸性越强,物质的氧化性或者还原性可能增强;增加氢离子浓度,反应速率加快或者增加氢离子浓度,平衡正向移动促进反应的进行,有利于提高As2O3的产率。


科目:高中化学 来源: 题型:
【题目】科学家提出如下光分解法制备氢气:
①2Ce4+(aq)+H2O(l)===2Ce3+(aq)+![]() O2(g)+2H+(aq) ΔH1
O2(g)+2H+(aq) ΔH1
②Ce3+(aq)+H2O(l)===Ce4+(aq)+![]() H2(g)+OH-(aq) ΔH2
H2(g)+OH-(aq) ΔH2
③H2O(l)===H+(aq)+OH-(aq) ΔH3
④2H2O(l)===2H2(g)+O2(g) ΔH4
下列说法正确的是( )
A. Ce4+能够增大水分解反应的活化能,提高反应速率
B. Ce3+是反应②和反应③的催化剂
C. 上述反应中,ΔH4=2ΔH1+4ΔH2-4ΔH3
D. 通常条件下,反应④中生成H2、O2的速率之比为1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,烧杯中盛有水,铁圈和银圈直接相连,在接头处用一根绝缘细丝吊住使之平衡。小心向烧杯中滴加少量CuSO4溶液,反应一段时间。下列有关说法不正确的是
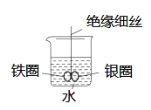
A.两圈摇摆不定
B.铁圈不断腐蚀
C.银圈上慢慢看到有红色物质覆盖
D.利用该原理,可以设计原电池装置,将化学能转化为电能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向浓度为0.1mol·L-1、体积为VL的氨水中逐滴加入一定浓度的盐酸,用pH计测溶液的pH随盐酸的加入量而降低的滴定曲线,d点两种溶液恰好完全反应。根据图中信息回答下列问题:
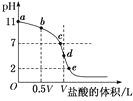
(1)该温度时NH3·H2O的电离常数K=__;
(2)比较b、c、d三点时的溶液中,由水电离出的OH-浓度大小顺序为__;
(3)滴定时,由b点到c点的过程中,下列各选项中数值保持不变的是__(填字母,下同);
A.c(H+)·c(OH-) B.![]() C.
C.![]() D.
D.![]()
(4)根据以上滴定曲线,下列说法正确的是__;
A.点b所示溶液中:c(NH![]() )+c(H+)=c(OH-)+c(NH3·H2O)
)+c(H+)=c(OH-)+c(NH3·H2O)
B.点c所示溶液中:c(Cl-)=c(NH3·H2O)+c(NH![]() )
)
C.点d所示溶液中:c(Cl-)>c(H+)>c(NH![]() )>c(OH-)
)>c(OH-)
D.滴定过程中可能有:c(NH3·H2O)>c(NH![]() )>c(OH-)>c(Cl-)>c(H+)
)>c(OH-)>c(Cl-)>c(H+)
(5)滴定过程中所用盐酸的pH=___,d点之后若继续加入盐酸至图像中的e点(此时不考虑NH4+水解的影响,忽略混合时溶液体积变化),则e点对应的横坐标为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以太阳能为热源分解Fe3O4,经热化学铁氧化合物循环分解水制H2的过程如图所示。下列叙述不正确的是( )

A. 过程Ⅰ中的能量转化形式是太阳能→化学能
B. 过程Ⅰ中每消耗116 g Fe3O4转移2 mol电子
C. 过程Ⅱ的化学方程式为3FeO+H2O![]() Fe3O4+H2↑
Fe3O4+H2↑
D. 铁氧化合物循环制H2具有节约能源、产物易分离等优点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家一直致力于“人工固氮”的新方法研究。
Ⅰ.目前合成氨技术原理为:N2(g)+3H2(g)![]() 2NH3(g) △H=-92.4kJ·mol-1。
2NH3(g) △H=-92.4kJ·mol-1。
(1)在一定体积的容器中发生上述反应,下列描述中能说明该反应已达平衡的是______
A.容器内气体的平均摩尔质量保持不变
B.2v(NH3)正=v(N2)逆
C.容器中气体的压强保持不变
D.N2、H2、NH3的物质的量之比为1:2:3
(2)673K、30MPa下,向容积为2.0L的恒容密闭容器中充入0.80mol N2和1.60mol H2,反应3分钟达到平衡时,NH3的体积分数为20%。
①该条件下反应:N2(g)+3H2(g)![]() 2NH3(g)的平衡常数K=_____(精确到小数点后一位);K值越大,表明反应达到平衡时______
2NH3(g)的平衡常数K=_____(精确到小数点后一位);K值越大,表明反应达到平衡时______
A.H2的转化率一定越高 B.NH3的浓度一定越大
C.正反应进行得越完全 D.化学反应速率越大
②若达平衡后再向该容器中充入0.40mol N2和0.40mol NH3,该平衡将______(填“向正反应方向移动”、“向逆反应方向移动”或“不移动”)。
Ⅱ.根据“人工固氮”的最新研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:2N2(g)+6H2O(1)![]() 4NH3(g)+3O2(g) △H=a kJ·mol-1。进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如表:
4NH3(g)+3O2(g) △H=a kJ·mol-1。进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如表:
T/K | 303 | 313 | 323 |
NH3的生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
(1)此合成反应的a_____0;ΔS______0,(填“>”、“<”或“=”)。
(2)已知(K为平衡常数):N2(g)+3H2(g)![]() 2NH3(g) K1,2H2(g)+O2(g)=2H2O(l) K2,则N2(g)+3H2O(1)=2NH3(g)+O2(g)的K=______(用K1、K2表示)。
2NH3(g) K1,2H2(g)+O2(g)=2H2O(l) K2,则N2(g)+3H2O(1)=2NH3(g)+O2(g)的K=______(用K1、K2表示)。
Ⅲ.已知:4NH3(g)+3O2(g)=2N2(g)+6H2O(1) ΔH= -1316kJ·mol-1,氨是一种潜在的清洁能源,可用作碱性燃料电池的燃料,该燃料电池的负极反应式是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KMnO4是一种高效氧化剂可用来氧化吸附有机异味物.也可以与水中的杂质如二价铁、锰、硫、氰、酚等反应。实验室常用Na2C2O4标准溶液标定未知浓度的KMnO4溶液,发生反应:5C2O42-+2MnO4-+16H++4H2O=2[Mn(H2O)6]2++10CO2↑。根据以上信息,完成下列问题:
(1)按电子排布K位于元素周期表的_______区,基态Mn2+的核外电子排布式可表示为_____。
(2)1 mol [Mn( H2O)6]2+中所含有的共价键数目为__________。
(3)基态C原子的核外电子中占据最高能级的电子云轮廓图为_______.C2O42-中碳原子的轨道杂化类型是___________________.
(4)同主族元素氧、硫、硒对应最简单氢化物的沸点:H2O>H2Se>H2S,原因是__________。
(5)β-MnSe的结构中Se为面心立方最密堆积,晶胞结构如图所示。
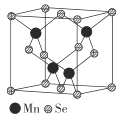
①β-MnSe中Mn的配位数为_____________。
②若该晶体的晶胞参数为apm,阿伏加德罗常数的值为NA。则距离最近的两个锰原子之间的距离为______pm, β-MnSe 的密度ρ= ______ ( 列出表达式)g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温常压下,某烃和氧气的混合气体4L,点燃后恰好完全燃烧,通过浓硫酸后恢复到原来状态,体积变为2L。则符合题意的某烃为( )
A.C4H8B.C3H8C.C2H2D.CH4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通常情况下,NCl3是一种油状液体,其分子空间构型与NH3相似,下列对NCl3和NH3的有关叙述正确的是( )
A. 分子中N—Cl键键长与CCl4分子中C—Cl键键长相等
B. NCl3分子是非极性分子
C. NBr3比NCl3易挥发
D. 在氨水中,大部分NH3与H2O以氢键(用“…”表示)结合形成NH3·H2O分子,则NH3·H2O的结构式为![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com