
【题目】常温下,向浓度为0.1mol·L-1、体积为VL的氨水中逐滴加入一定浓度的盐酸,用pH计测溶液的pH随盐酸的加入量而降低的滴定曲线,d点两种溶液恰好完全反应。根据图中信息回答下列问题:
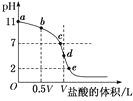
(1)该温度时NH3·H2O的电离常数K=__;
(2)比较b、c、d三点时的溶液中,由水电离出的OH-浓度大小顺序为__;
(3)滴定时,由b点到c点的过程中,下列各选项中数值保持不变的是__(填字母,下同);
A.c(H+)·c(OH-) B.![]() C.
C.![]() D.
D.![]()
(4)根据以上滴定曲线,下列说法正确的是__;
A.点b所示溶液中:c(NH![]() )+c(H+)=c(OH-)+c(NH3·H2O)
)+c(H+)=c(OH-)+c(NH3·H2O)
B.点c所示溶液中:c(Cl-)=c(NH3·H2O)+c(NH![]() )
)
C.点d所示溶液中:c(Cl-)>c(H+)>c(NH![]() )>c(OH-)
)>c(OH-)
D.滴定过程中可能有:c(NH3·H2O)>c(NH![]() )>c(OH-)>c(Cl-)>c(H+)
)>c(OH-)>c(Cl-)>c(H+)
(5)滴定过程中所用盐酸的pH=___,d点之后若继续加入盐酸至图像中的e点(此时不考虑NH4+水解的影响,忽略混合时溶液体积变化),则e点对应的横坐标为___。
【答案】10-5 d>c>b ACD D 1 ![]()
【解析】
(1)根据图示,没有滴加盐酸时,0.1mol·L-1的氨水的pH=11,在溶液中NH3·H2O电离,电离方程式为NH3·H2O![]() NH4++OH-,溶液的pH=11,则c(OH-)=
NH4++OH-,溶液的pH=11,则c(OH-)=![]() ,忽略溶液中水电离出来的H+,则c(NH4+)=c(OH-);NH3·H2O的电离程度较弱,发生电离的NH3·H2O约占所有NH3·H2O的1%,可以忽略不计,则溶液中c(NH3·H2O)=0.1mol·L-1,则NH3·H2O的电离常数
,忽略溶液中水电离出来的H+,则c(NH4+)=c(OH-);NH3·H2O的电离程度较弱,发生电离的NH3·H2O约占所有NH3·H2O的1%,可以忽略不计,则溶液中c(NH3·H2O)=0.1mol·L-1,则NH3·H2O的电离常数![]() ;
;
(2)根据题意d点两种溶液恰好完全反应,生成NH4Cl,NH4+在溶液中能够水解,促进水的电离;b、c两点表示的溶液中c点NH3·H2O被中和得较多,剩余的NH3·H2O较少,对水的电离抑制较少,因此b、c、d三点的溶液中,由水电离出的OH-浓度大小顺序为d>c>b;
(3)b点到c点过程中,NH3·H2O被中和得越来越多,但是还有剩余;
A.在水溶液中,溶液中的c(H+)·c(OH-)=Kw,温度不变,Kw不变,A符合题意;
B.b点到c点过程中,NH3·H2O被中和得越来越多,pH越来越小,c(H+)越来越大,c(OH-)越来越小,则由b点到c点的过程中,![]() 越来越大,B不符合题意;
越来越大,B不符合题意;
C.![]() 为NH3·H2O的电离平衡常数的表达式,温度不变,电离平衡常数不变,C符合题意;
为NH3·H2O的电离平衡常数的表达式,温度不变,电离平衡常数不变,C符合题意;
D.![]() 为NH4+的水解平衡常数表达式,温度不变,水解平衡常数不变,D符合题意;
为NH4+的水解平衡常数表达式,温度不变,水解平衡常数不变,D符合题意;
答案选ACD;
(4)A.b点溶液,有一半的NH3·H2O与HCl反应,得到NH3·H2O和NH4Cl等物质的量的混合溶液,根据物料守恒,有c(NH4+)+c(NH3·H2O)=2c(Cl-);NH3·H2O会电离,电离方程式为NH3·H2O![]() NH4++OH-,NH4+会水解,水解方程式为NH4++H2O
NH4++OH-,NH4+会水解,水解方程式为NH4++H2O![]() NH3·H2O+H+,NH3·H2O电离会使得溶液呈碱性,NH4+水解使得溶液呈酸性,现溶液呈碱性,说明NH3·H2O的电离程度大于NH4+的水解程度,则c(NH4+)>c(NH3·H2O),可得c(NH4+)>c(Cl-)>c(NH3·H2O);根据电荷守恒,有c(NH
NH3·H2O+H+,NH3·H2O电离会使得溶液呈碱性,NH4+水解使得溶液呈酸性,现溶液呈碱性,说明NH3·H2O的电离程度大于NH4+的水解程度,则c(NH4+)>c(NH3·H2O),可得c(NH4+)>c(Cl-)>c(NH3·H2O);根据电荷守恒,有c(NH![]() )+c(H+)=c(OH-)+c(Cl-),则c(NH
)+c(H+)=c(OH-)+c(Cl-),则c(NH![]() )+c(H+)>c(OH-)+c(NH3·H2O),A错误;
)+c(H+)>c(OH-)+c(NH3·H2O),A错误;
B.根据图示,c点溶液的pH=7,有c(H+)=c(OH-),根据电荷守恒,有c(NH4+)+c(H+)=c(OH-)+c(Cl-),则c(NH4+)=c(Cl-),B错误;
C.d点NH3·H2O恰好被完全反应,溶液中只有NH4Cl,由于NH4+会水解,但水解是微弱的,因此c(Cl-)>c(NH4+)>c(H+)>c(OH-),C错误;
D.滴定过程中,如果只加入了少量了HCl,则等式c(NH3·H2O)>c(NH4+)>c(OH-)>c(Cl-)>c(H+),该等式符合电荷守恒,可能存在,D正确;
答案选D;
(5)根据题意d点恰好完全反应,加入盐酸的体积为VmL,而氨水溶液的体积恰好也是VmL,说明两溶液的溶质的浓度相同,盐酸的浓度也为0.1mol·L-1,c(H+)=0.1mol·L-1,pH=1;
如果忽略NH4+的水解,设e点加入盐酸的体积为xmL,e点溶液的pH=2,c(H+)=0.01mol·L-1,则有![]() ,则可得
,则可得![]() 。
。


科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德常数的值,下列说法正确的是( )
A.24g镁的最外层电子数为NA
B.常温常压下,18g水含有的原子总数为3NA
C.标准状况下,11.2L乙醇中含有分子的数目为0.5NA
D.常温常压下,2.24L一氧化碳和二氧化碳混合气体中含有的碳原子数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是铁与水蒸气反应的实验装置。在硬质玻璃管中放入还原铁粉和石棉绒(石棉绒是耐高温材料,与水、铁不反应)的混合物,加热,并通入水蒸气,就可以完成高温下铁与水蒸气反应的实验。
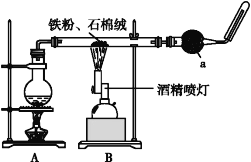
(1)该实验反应的反应方程式为:___。
(2)仪器a的名称是___。
(3)某同学为了研究一定时间内铁粉的转化率,设计了如下实验:准确称量一定质量的铁粉进行反应,测量反应后生成气体的体积,计算铁粉的转化率。
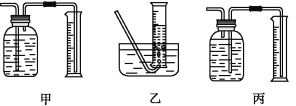
①该同学应该先点燃__(填“A”或“B”)处的酒精灯(或酒精喷灯),测量气体体积不可以选用上图中___(填“甲”“乙”或“丙”)装置。
②称取5.6g铁粉与适量石棉绒混合,然后加热反应一段时间。若测出的气体体积在标准状况下为0.896L,则铁粉的转化率为__。(转化率=![]() )
)
(4)将硬质玻璃管中反应后的固体混合物全部取出置于烧杯中,加入足量的盐酸溶解并过滤,为探究反应后溶液中可能的阳离子,小林同学进行如下实验,请你将下表补充完整:
步骤 | 现象 | 解释(用离子方程式表示) | 结论 |
Ⅰ.取样,滴加KSCN溶液 | 溶液不变红色(Fe3+与KSCN溶液反应显红色) | ①Fe3O4+8H+=Fe2++2Fe3++4H2O ②____ | Ⅲ.反应后的溶液中阳离子为___ |
Ⅱ.取样,滴加NaOH溶液 | 刚开始无明显现象,一段时间后先出现白色沉淀,迅速变为灰绿色,最终变为红褐色 | ①___ ②Fe2++2OH—=Fe(OH)2↓(白色) 4Fe(OH)2+2H2O+O2=4Fe(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】干洗衣服的干洗剂主要成分是四氯乙烯,家用不粘锅内侧涂覆物质的主要成分是聚四氟乙烯(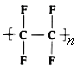 )。下列关于四氯乙烯和聚四氟乙烯的说法正确的是
)。下列关于四氯乙烯和聚四氟乙烯的说法正确的是
A.均为纯净物
B.都能发生加成反应,都能使酸性高锰酸钾溶液褪色
C.都属于不饱和烃,分子中都不含氢原子
D.四氯乙烯对油脂有较好的溶解作用,聚四氟乙烯的化学性质比较稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是由短周期元素中部分元素组成的一些单质及其化合物之间转化关系图。常温下,D、F、K均为无色无刺激性气味的气体,B是最常见的无色液体,A是由单质C在D中燃烧生成的淡黄色固体(反应中生成的部分物质已略去)。
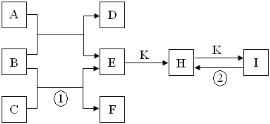
请回答下列问题:
(1)物质A的化学式为___,其阴、阳离子个数比为__。
(2)实验室将物质C通常保存在___中,请写出反应①的离子方程式___。
(3)反应②的化学方程式为___。
(4)有两个分别装有H和I固体的试剂瓶,因标签脱落而无法区分。若让你鉴别它们,下列试剂或方法中可选用的有___。
A.澄清石灰水 B.稀盐酸 C.加热,称重 D.焰色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家研制出了一种漂白效率极高的新型漂白剂(结构如图所示),其中W、X、Y、Z均为短周期元素且原子序数依次增大。常温下,0.1mol/LZ的氢化物的水溶液pH=1,且Z与Y位于不同周期。下列叙述正确的是( )
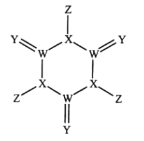
A.原子半径:Z>Y>X>W
B.氢化物的沸点:Y>X>Z>W
C.X的氧化物的水化物是强酸
D.Y的某种单质具有杀菌消毒作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中药在世界医学界越来越受到关注。中药药剂砒霜(主要成分As2O3)可用于治疗急性白血病,为此,砷及其化合物的提取再次引起关注。
(1)As是33号元素,在元素周期表中的位置是________。
(2)N元素非金属性比As强,下列说法正确的是_______
①热稳定性:NH3<AsH3
②酸性:HNO3>H3AsO4
③原子半径:N<As
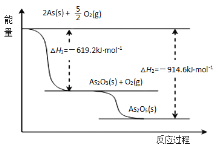
(3)请依据如图信息写出As2O5分解为As2O3的热化学方程式_______。
(4)查阅文献得知,可以从硫化砷(As2S3)废渣中提取As2O3,提取的工艺流程简图如图:

已知:As2S3不溶于水;As2O3微溶于水。
①As2S3、Na3AsS3中的硫元素均为-2价,碱浸过程中发生的反应______(填“是”或“不是”)氧化还原反应。
②过程Ⅲ的离子方程式为_______。
③过程Ⅲ得到纯净As2O3固体的系列操作包括_____、_____、_____。
④过程Ⅲ中,其它条件相同时仅改变溶液pH,发现酸性越强,As2O3的产率越高,可能的原因是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,相同pH的盐酸和醋酸溶液分别加水稀释,平衡时pH随溶液体积变化的曲线如图所示。据图判断不正确的是( )
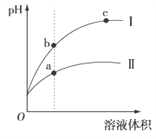
A. I是盐酸,Ⅱ是醋酸
B. 稀释前等体积的I、Ⅱ溶液中和氢氧化钠的能力相同
C. a、b、c三点KW的数值相同
D. 溶液的导电性a>b>c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.电解水时氢气与氧气的体积比为2:1,原因是气体的体积主要取决于分子间距,而同温同压时气体的间距基本相等
B.碳酸分步电离以第一步为主,第二步为次,原因之一是第二步电离时碳酸氢根带负电荷,而电离出的氢离子为正电荷
C.苯酚显弱酸性可与氢氧化钠溶液反应,是因为羟基活化了苯环
D.可通过如图(比例模型)判定醋酸是弱电解质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com