
(12 分)硫酸钠-过氧化氢加合物(xNa2SO4 ·yH2O2 ·zH2O)的组成可通过下列实验测定:①准确称取1. 7700 g 样品,配制成100. 00 mL 溶液A。②准确量取25. 00 mL 溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体0. 5825 g。③准确量取25. 00 mL 溶液A,加适量稀硫酸酸化后,用0. 02000 mol·L-1KMnO4溶液滴定至终点,消耗KMnO4溶液25. 00 mL。H2O2与KMnO4反应的离子方程式如下:2MnO4- +5H2O2+6H+=2Mn2++8H2O+5O2↑
(1)已知室温下BaSO4的Ksp ="1." 1伊10-10,欲使溶液中c(SO42- )≤1. 0×10-6 mol·L-1,应保持溶液中c(Ba2+)≥ mol·L-1。
(2)上述滴定若不加稀硫酸酸化,MnO4- 被还原为MnO2,其离子方程式为 。
(3)通过计算确定样品的组成(写出计算过程)。
(1)1. 1×10-4
(2)2MnO4-+3H2O2=2MnO2↓+3O2↑+2OH-+2H2O
(3)n(Na2SO4)= n(BaSO4)=" 0." 5825g/233g·mol-1 ="2." 50×10-3 mol
2MnO4- +5H2O2+6H+=2Mn2++8H2O+5O2↑
n(H2O2)= 5/2×0. 02000 mol·L-1×25. 00 mL/1000 mL·L-1 ="1." 25×10-3mol
m(Na2SO4)=" 142" g·mol-1×2. 50×10-3 mol="0." 355 g
m(H2O2)=" 34" g·mol-1×1. 25×10-3 mol="0." 0425 g
n(H2O)=(1. 7700 g×25. 00 mL/100. 00mL-0. 355 g-0. 0425 g)/18 g·mol-1 ="2." 50×10-3mol
x :y :z =n(Na2SO4) :n(H2O2) :n(H2O)=" 2" :1 :2
硫酸钠-过氧化氢加合物的化学式为2Na2SO4·H2O2·2H2O
解析


 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:填空题
一种含铝、锂、钴的新型电子材料,生产中产生的废料数量可观,废料中的铝以金属铝箔的形式存在;钴以Co2O3·CoO的形式存在,吸附在铝箔的单面或双面;锂混杂于其中。
从废料中回收氧化钴(CoO)的工艺流程如下: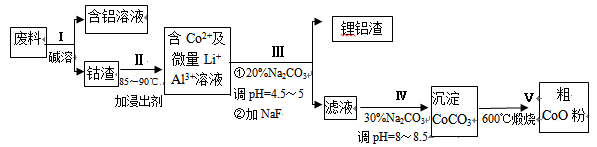
(1)过程I中采用NaOH溶液溶出废料中的Al,反应的离子方程式为 。
(2)过程II中加入稀H2SO4酸化后,再加入Na2S2O3溶液浸出钴。则浸出钴的化学反应方程式为(产物中只有一种酸根) 。在实验室模拟工业生产时,也可用盐酸浸出钴,但实际工业生产中不用盐酸,请从反应原理分析不用盐酸浸出钴的主要原因_______________。
(3)过程Ⅲ得到锂铝渣的主要成分是LiF和Al(OH)3,碳酸钠溶液在产生Al(OH)3时起重要作用,请写出该反应的离子方程式________________________。
(4)碳酸钠溶液在过程III和IV中所起作用有所不同,请写出在过程IV中起的作用是
____________________________________________________________。
(5)在Na2CO3溶液中存在多种粒子,下列各粒子浓度关系正确的是______(填序号)。
| A.c(Na+) = 2c(CO32-) | B.c(Na+) > c(CO32-) > c(HCO3-) |
| C.c(OH-) > c(HCO3-) > c(H+) | D.c(OH-) - c(H+)=c(HCO3-) + 2c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
用于提纯或分离物质的方法有:
| A.萃取分液; | B.加热分解; | C.蒸发结晶; | D.分液;E、蒸馏;F、过滤等,请将提纯或分离方法的序号填在后面横线上。 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
工业上用粉碎的煤矸石(主要含Al2O3、SiO2及铁的氧化物)制备净水剂BAC〔Al2(OH)nCl6-n〕的流程如下: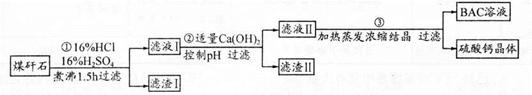
(1)粉碎煤矸石的目的是______;滤渣I的主要成分是______ (填化学式)。
(2)步骤①在煮沸的过程中,溶液逐渐由无色变为绿色,此时溶液中有色离子为______(填化学式);随后溶液又变为棕黄色,相关离子反应方程式为______;
步骤①的煮沸装置上方需安装一长导管,长导管的作用是____________。
(3)步骤②中加入适量的Ca(OH)2并控制pH,其目的:一是生成BAC;二是___________;巳知BAC的分散质粒子大小在1 nm?100 nm之间,由此区别滤液I与BAC两种液体的物理方法是______;若Ca(OH)2溶液过量,则步骤③得到的BAC产率偏低,写出该反应的离子方程式______。
(4)若0.1 molAlCl3在某温度下溶于蒸馏水,当有5℅水解生成Al(OH)3溶液时,吸收热量a kJ。写出该过程的热化学方程式____________。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
下图为某套实验装置示意图,其中加热装置和部分药品等均已经省略(装置①和装置②为气体发生装置)。
(1)甲同学用此装置(在A、B间增加一盛有浓硫酸的洗气瓶)制备NO2并验
证其性质。装置①用于实验室制备NH3,用装置②制备过量O2。装置①中发生
反应的化学方程式是 。B处冰水冷却的U型管中有红棕色气
体生成且越接近U型管底部颜色越浅,请解释原因 。
(2)乙同学用此套装置合成SO3,B处冰水冷却的U型管中有固体出现。C中
若盛放酸性K2Cr2O7溶液,则在C中发生的氧化还原反应的离子方程式是 (生成物中Cr以Cr3+形式存在);现欲制得纯净干燥的SO3,若C中盛放NaOH溶液,则此装置中存在明显不足,应如何改进 (从下面给出的实验装置中选择字母标号补充或替换,并用简要文字说明补充和替换的位置)。
(3)丙同学拟验证NO能被氨气还原并测算其转化率(装置①、装置②分别制
NO和NH3),将上述装置A、B、C分别换成下列⑤、⑥、⑦。
请回答:装置⑦的作用可能是 ;若进入装置⑤的NO共22.4L(已折算为标准状况,下同),氨气过量,最后收集到标准状况下11.2LN2,则NO的转化率是 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(12分)1,2 -二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度2.18 g·cm-3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂。在实验室中可以用下图所示装置制备1,2 -二溴乙烷。其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,试管d中装有液溴(表面覆盖少量水)。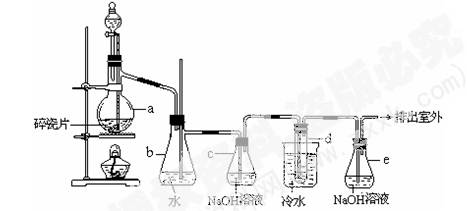
填写下列空白:
(1)写出本题中制备1,2-二溴乙烷的两个化学反应方程式。_ ;_____________________。
(2)安全瓶b可以防止倒吸,并可以检查实验进行时试管d是否发生堵塞。请写出发生堵塞时瓶b中的现象:____________________________________________。
(3)容器c中NaOH溶液的作用是:________________________________________。
(4)某学生在做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量,比正常情况下超过许多。如果装置的气密性没有问题,试分析其可能的原因: ______________, _____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
实验室需要制备纯净的氯化钾晶体。现有含少量KBr和K2SO4的氯化钾样品,按照下图所示的实验方案进行提纯。
(1)操作I的名称 ,操作Ⅱ所需的玻璃仪器有酒精灯和 。
(2)若用硝酸钡来代替氯化钡,是否可行?请说明理由。
。
(3)若实验所得固体甲、乙的质量分别为W1g和W2g,则样品中KBr的质量分数计算式为 。
(4)某同学对该实验方案提出质疑,他认为加适量氯化钡溶液不容易控制,应加入过量氯化钡溶液,请你按他的思路,写出实验流程图中所用试剂、所得产物的化学式和相应操作的名称,A ,B ,滤液C ,操作Ⅱ 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(15分)大理石中含有的主要杂质是氧化铁,以下是某化学兴趣小组用大理石为原料制取安全无毒杀菌剂过氧化钙的主要流程:
请回答下列问题:
(1)试剂A的名称是 ;
(2)操作I的目的是 ;
(3)本实验需要多次使用玻璃棒,则本实验过程中玻璃棒的作用有 ;
(4)写出反应②中生成CaO2·8H2O的化学方程式: ;
(5)制得的CaO2中一般含有CaO该化学兴趣小组通过实验测定制得的样品中CaO2的含量:称量0.6g样品于锥形瓶中,然后加入过量的浓度为2.00mol?L-1的盐酸20.00mL,再用浓度为2.00mol?L-1的氢氧化钠溶液滴定锥形瓶中的溶液,消耗氢氧化钠溶液11.00mL.该样品中CaO2的质量分数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
实验室可用如图所示的装置进行CO和CO2混合气体的分离和干燥。已知a为止水夹,b为分液漏斗丙的活塞,可供选用的试剂有NaHCO3溶液、NaOH溶液、NaHS溶液、浓硫酸、无水氯化钙、稀硫酸。试填空回答: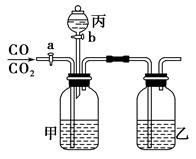
(1)广口瓶甲中应放的试剂为 ,广口瓶乙中应放的试剂为 ,分液漏斗丙中应放的试剂为 。
(2)第一步应先分离出 ,分离时应先关闭 。打开 ,发生反应的离子方程式为 。
(3)第二步分离出 时,先关闭 ,打开 ,发生反应的离子方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com