
【题目】A、B、C、D、E、R为原子序数依次增大的六种元素,位于元素周期表的前四周期。B元素原子含有3个能级,且毎个能级所含的电子数相同;D的原子核外有8种运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子3d轨道上有4个未成对电子。请回答下列问题:
(1)写出C基态原子的价层电子排布____________,F基态原子的外围电子排布式_____________。
(2)下列说法不正确的是____________ (填序号)。
A.二氧化硅的相对分子质量比二氧化碳大,所以沸点:SiO2 > CO2
B.笫一电离能由小到大的顺序:B <C < D
C.N2与CO为等电子体,结构相似
D.稳定性:H2O> H2S,水分子更稳定的原因是水分子间存在氢键
(3)F元素位于周期表中_________区,其离子是人体内多种酶的辅因子,人工模拟酶是当前研究的热点。向F的硫酸盐溶液中通人过量的C与A形成的气体X可生成[F(X)4]2+,该离子的结构式为__________(用元素符号表示)。
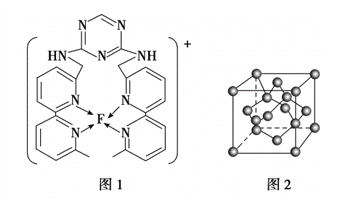
(4)某化合物与F(I)(I表示化合价为+ 1)结合形成下图1所示的离子,该离子中碳原子的杂化方式为________________________________。
(5)B单质的一种同素异形体的晶胞如下图2所示,则一个晶胞中所含B原子的个数为____________。
(6)D与F形成离子个数比为1:1的化合物,晶胞与NaCl类似,设D离子的半径为apm, F离子的半径bpm,则该晶胞的空间利用率为_______________。
【答案】 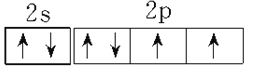 3d104s1 ABD ds
3d104s1 ABD ds 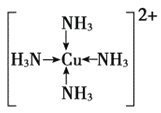 sp2、sp3 8 (2πa3+2πb3)/3(a+b)3×100%。
sp2、sp3 8 (2πa3+2πb3)/3(a+b)3×100%。
【解析】根据题给信息进行分析可知:A 为H,B为C,C为N,D为O,E为Fe ,F为 Cu;
(1)C为N,基态N原子的价层电子排布2s22p3,其价电子排布图为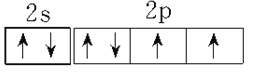 ;F为 Cu, Cu基态原子的外围电子排布式3d104s1。正确答案:
;F为 Cu, Cu基态原子的外围电子排布式3d104s1。正确答案: ;3d104s1。
;3d104s1。
(2)二氧化硅为原子晶体,而二氧化碳为分子晶体,所以沸点:SiO2 > CO2,A错误;B为C,C为N,D为O,第一电离能第VA族元素大于相邻的主族元素,所以笫一电离能由小到大的顺序:N>O>C;B错误;N2与CO原子数目相同,价电子数目相同,二者为等电子体,结构相似,C正确;稳定性:H2O> H2S,是因为非金属性O> S,与分子间存在氢键无关,D错误;正确选项ABD。
(3)F为 Cu,位于周期表中ds区,向硫酸铜溶液中通人过量的C与A形成的气体氨气可生成[Cu(NH4)4]2+,该离子的结构式为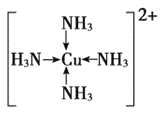 ;正确答案:ds;
;正确答案:ds; 。
。
(4)杂环上的碳原子含有3个σ键,没有孤对电子,采用sp2杂化,亚甲基上碳原子含有4个共价单键,采用sp3杂化;正确答案:sp2;sp3。
(5)B原子有4个位于晶胞内部,其余B原子位于顶点、面心,则一个晶胞中所含有B原子数为4+8×1/8+6×1/2=8;正确答案:
(6)D为O, F为 Cu;D与F形成离子个数比为1:1的化合物CuO,晶胞与氯化钠相似,晶胞中铜离子数目=阳离子数目=8×1/8+6×1/2=4, O2-离子的半径为apm, Cu2+离子的半径bpm,则晶胞中原子总体积为4×(4/3×πa3+4/3×πb3),晶胞棱长为2(a+b)pm,所以晶胞的体积为8(a+b)3,该晶胞的空间利用率为4×(4/3×πa3+4/3×πb3)÷8(a+b)3×100%=(2πa3+2πb3)/3(a+b)3×100%;正确答案:(2πa3+2πb3)/3((a+b)3×100%。


科目:高中化学 来源: 题型:
【题目】如图,在左试管中先加入3mL的乙醇,并在摇动下缓缓加入2mL浓硫酸,再加入2mL乙酸,充分摇匀.在右试管中加入5mL饱和Na2CO3溶液.按图连接好装置,用酒精灯缓慢加热
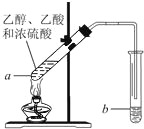
(1)写出左试管中主要反应的方程式________________;
(2)饱和Na2CO3的作用:___________;_______________________;_________;
(3)分离右试管中所得乙酸乙酯和Na2CO3溶液的操作所需主要仪器是____________.
(4)实验生成的乙酸乙酯,其密度比水________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,6-己二酸(G)是合成尼龙的主要原料之一,可用烃A氧化制备。制备G的合成路线如下:
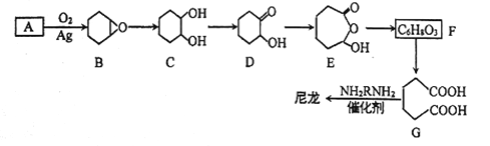
回答下列问题:
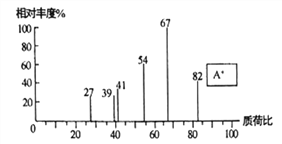
(1)化合物A的质谱图如下,则A的化学名称为_______________。
(2)C→D的反应类型为_____________。
(3)F的结构简式为_________________。
(4)写出能同时满足下列条件的X的同分异构体的结构简式______________。
①相对分子质量与F相等
②烃的含氧衍生物,能发生银镜反应
③核磁共振氢谱中有三组峰,面积比为3:2:1
(5)由G合成尼龙的化学方程式为____________________。
(6)由A通过两步反应制备1,3-环己二烯的合成路线为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列溶液中的微粒浓度关系正确的是( )
A. 新制氯水中加入固体NaOH:c(Na+)=c(Cl-)+c(ClO-)+c(OH-)
B. pH=8.3的NaHS溶液:c(Na+)>c(HS-)>c(S2-)>c(H2S)
C. pH=11的氨水与pH=3的盐酸等体积混合:c(Cl-)=c(NH4+)>c(OH-)=c(H+)
D. 0.2 mol·L-1 CH3COOH溶液与0.1 mol·L-1NaOH溶液等体积混合:2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究外界条件对反应:mA(g)+nB(g)![]() cZ(g) △H的影响,以A和B物质的量之比为m∶n开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如下图所示。下列判断正确的是
cZ(g) △H的影响,以A和B物质的量之比为m∶n开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如下图所示。下列判断正确的是
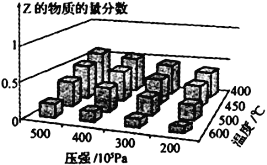
A. 在恒温恒压条件下,向已达到平衡的体系中加入少量Z,达新平衡时,Z的物质的量分数增大
B. 升高温度,正、逆反应速率都增大,平衡常数增大
C. 温度不变,减小压强,平衡逆向移动,达新平衡时,A的浓度比原平衡减小
D. △H>0,m+n>c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氯二氢硅(SiH2C12)常作于外延法工艺中重要的硅源。易燃、有毒,与水接触易水解,沸点8.2℃。在铜催化作用下,HCl 与硅在250-260℃反应可以制得SiH2Cl2.
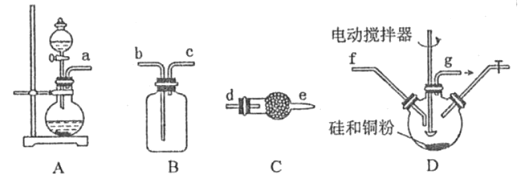
(1) 利用浓硫酸、浓盐酸为原料,选用A 装置制取HC1,利用了浓硫酸的_______性。
(2)D 装置中生成 二氯二氢硅的化学方程式为___________________。
(3) 按照气体从左到右方向,制取SiH2Cl2的装置连接次序为a→___→___→f→g→___→___→____→_____(填仪器接口的字母,其中装置C 用到2 次).其中装置B 的作用是____;前面装置C 中装的药品为______,后面装置C的作用为____________。
(4)新的制取SiH2Cl2 方法是: 往硅粉中先通入Cl2在300-350℃反应生成SiCl4,然后再与HCl 在250-260℃反应,可以大大提高产率。如果通入气体次序相反,产率会降低,其原因是__________(用化学方程式表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸亚铁晶体(FeC2O4·2H2O)是一种淡黄色粉末,某课外小组利用下列装置检验草酸亚铁晶体受热分解的部分产物。
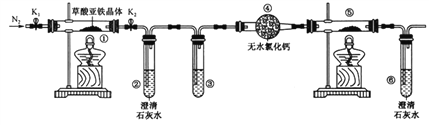
下列说法正确的是
A. 若③和⑤中分别盛放足量NaOH溶液和CuO,可检验生成的CO
B. 实验时只需要在装置①中反应结束后再通入N2
C. 若将④中的无水CaCl2换成无水硫酸铜可检验分解生成的水蒸气
D. 实验结束后,①中淡黄色粉末完全变成黑色,则产物一定为铁
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com