
【题目】甲醇(CH3OH)是重要的溶剂和替代燃料,工业上用CO和H2在一定条件下制备CH3OH的反应为CO(g)+2H2(g)![]() CH3OH(g); △H。
CH3OH(g); △H。
(1)在体积为1L的恒容密闭容器中,充入2molCO和4molH2,一定条件下发生上述反应,测得CO(g)和CH3OH(g)的浓度随时间的变化如图甲所示。
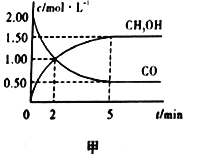
①从反应开始到5min,用氢气表示的平均反应速率v(H2)=________。
②下列说法正确的是________(填序号)。
A. 达到平衡时,H2的转化率为75%
B. 5min后容器中压强不再改变
C. 达到平衡后,再充入氩气,反应速率增大
D. 2min前v(正)>v(逆),2min后v(正)<v(逆)
(2)某温度下,在一恒压容器中分别充入1.2molCO和1molH2,达到平衡时容器体积为2L,且含有0.4molCH3OH(g),则该反应平衡常数的值为__________。
(3)甲醇是一种新型的汽车动力燃料。已知H2(g)、CO(g)、CH3OH(l)的燃烧热分别为285.8kJ/mol、283.0kJ/mol和726.5kJ/mol,则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为________。
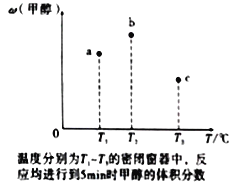
(4)现有容积均为1L的a、b、c三个密闭容器,往其中分别充入1molCO和2molH2的混合气体,控制温度,进行反应,测得相关数据的关系如图所示。b中甲醇体积分数大于a中的原因是____________。达到平衡时,a、b、c中CO的转化率大小关系为___________。
(5)甲醇作为一种燃料还可用于燃料电池。在温度为650℃的熔融盐燃料电池中用甲醇、空气与CO2的混合气体作反应物,镍作电极,用Li2CO3和Na2CO3混合物作电解质。该电池的负极反应式为___________________________。
【答案】0.6mol/(L·min) A B 50 L2 / mol2(不写单位不影响得分) CH3OH(l)+O2(g)=CO(g)+2H2O(l) △H=-443.5kJ·mol-1 b中温度高,反应速率快,反应相同时间生成的甲醇多,体积分数大 a>b>c CH3OH-6e-+3CO32-=4CO2↑+2H2O
【解析】
(1)①根据v=Δc/Δt计算v(H2);
②H2的转化率=H2的浓度变化量/H2的浓度初始量×100%;根据图像5min后容器中气体物质的量不再改变;恒容密闭容器中达到平衡后,再充入氩气,反应物浓度不变,反应速率不变;2min前后,反应都正向进行;
(2)利用“三段式”计算平衡常数;
(3)根据盖斯定律计算甲醇不完全燃烧生成一氧化碳和液态水的焓变;
(4)b中温度高,反应速率快,反应相同时间生成的甲醇多,使得b中甲醇体积分数大于a;达到平衡时,a、b、c三个容器的反应温度不同,a容器温度最低,c容器的反应温度最高,根据反应放热可判断出,升高温度,平衡逆向移动,甲醇的体积分数减小,故应为a>b>c;
(5)根据电池的负极反应物为甲醇,写出电极方程式。
(1)①由图可知,平衡时甲醇的浓度为1.5mol/L,则v(CH3OH)=1.5mol/L÷5min=0.3mol/(L·min),速率之比等于其化学计量数之比,则v(H2)=2v(CH3OH)=0.6mol/(L·min),故答案为:0.6mol/(L·min)。
②A.由图可知,CO的起始浓度为2mol/L、平衡时浓度为0.5mol/L,则△c(CO)=2mol/L-0.5mol/L=1.5mol/L,则氢气浓度变化量为1.5mol/L×2=3mol/L,氢气转化率=3mol/L/(4mol÷1L)×100%=75%,故A正确;
B.根据图像,5min后反应达到平衡,容器中压强不再改变,故B正确;
C.达到平衡后,再充入氩气,体积不变,反应物的浓度不变,反应速率不变,故C错误;D.2min前反应正向进行,v(正)>v(逆),2min后5min前反应仍正向进行,v(正)>v(逆),故D错误。
故答案为:AB。
(2) CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
起始(mol/L) 0.6 0.5 0
转化(mol/L) 0.2 0.4 0.2
平衡(mol/L) 0.4 0.1 0.2
所以该反应平衡常数K=0.2mol/L[0.4mol/L×(0.1mol/L)2]=50L2/mol2,
故答案为:50L2/mol2。
(3)由CO(g)和CH3OH(l)的燃烧热△H分别为-283.0kJmol-1和-726.5kJmol-1,则①CO(g)+1/2O2(g)=CO2(g)△H=-283.0kJmol-1,②CH3OH(l)+1/2O2(g)=CO2(g)+2H2O(l)△H=-726.5kJmol-1,由盖斯定律可知,②-①得反应CH3OH(l)+O2(g)=CO(g)+2 H2O(l),则△H=-726.5kJmol-1-(-283.0kJmol-1)=-443.5kJmol-1,故答案为:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-443.5kJmol-1。
(4)b中温度高,反应速率快,反应相同时间生成的甲醇多,使得b中甲醇体积分数大于a;达到平衡时,a、b、c三个容器的反应温度不同,a容器温度最低,c容器的反应温度最高,根据反应放热可判断出,升高温度,平衡逆向移动,甲醇的体积分数减小,故应为a>b>c,故答案为:b中温度高,反应速率快,反应相同时间生成的甲醇多,体积分数大;a>b>c。
(5)在温度为650℃的熔融盐燃料电池中用甲醇、空气与CO2的混合气体作反应物,镍作电极,用Li2CO3和Na2CO3混合物作电解质。该电池的负极反应物为甲醇,反应式为CH3OH-6e-+3CO32-=4CO2↑+2H2O,故答案为:CH3OH-6e-+3CO32-=4CO2↑+2H2O。


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
【题目】一定温度下,在三个容积均为2.0 L的恒容密闭容器中发生反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g)。各容器中起始物质的量与反应温度如下表所示,反应过程中甲、丙容器中CO2的物质的量随时间变化关系如图所示:
N2(g)+2CO2(g)。各容器中起始物质的量与反应温度如下表所示,反应过程中甲、丙容器中CO2的物质的量随时间变化关系如图所示:

容器 | 温度/℃ | 起始物质的量/mol | |
NO (g) | CO (g) | ||
甲 | T1 | 0.20 | 0.20 |
乙 | T1 | 0.30 | 0.30 |
丙 | T2 | 0.20 | 0.20 |
下列说法正确的是
A. 该反应的正反应为吸热反应
B. 达到平衡时,乙中CO2的体积分数比甲中的小
C. T1℃时,若起始时向甲中充入0.40 mol NO、0.40mol CO、0.40mol N2和0.40mol CO2,则反应达到新平衡前v(正)<v(逆)
D. T2℃时,若起始时向丙中充入0.06molN2和0.12 molCO2,则达平衡时N2的转化率大于40%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在高温下, Al与Fe2O3发生铝热反应后得到的固体混合物中主要含有Al2O3、Fe,还含有少量Fe2O3。从该样品中固体混合物分离出Al2O3,并回收Fe和Fe2O3的流程如下:

已知:NaAlO2 + CO2 + 2H2O = Al(OH)3↓ + NaHCO3
回答下列问题:
(1)固体①的成分是__________。溶液②的溶质是____________。
(2)加入过量NaOH溶液时,发生反应的离子方程式是__________。
(3)白色固体②与NaOH溶液反应的离子方程式是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[2019·福建省厦门市高中毕业班5月第二次质量检查]一种以磷酸工业副产物磷石膏(主要成分为CaSO4,杂质含H3PO4,SiO2,Al2O3等)制取高纯硫酸钙的流程如图所示。
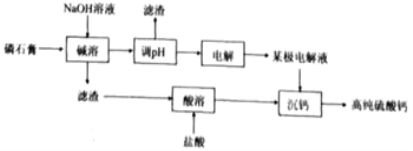
(1)磷石膏废弃会造成的环境问题为___________;
(2)“碱溶”中Al2O3发生反应的化学方程式为_________;
(3)含硅与含铝组分分布系数与pH关系如下图:
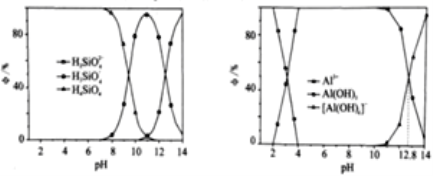
①“调pH”时,溶液的pH应调节为__________;
②Ksp[Al(OH)3]=__________;
③Al(OH)3(aq)+H2O![]() [Al(OH)4](aq)+H+(aq),则Ka[Al(OH)3]=__________;
[Al(OH)4](aq)+H+(aq),则Ka[Al(OH)3]=__________;
(4)“电解”采用双极膜电渗析法,装置如下图。
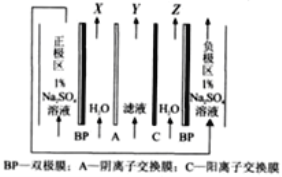
①“某极电解液”为________(填“X”、“Y”或“Z”)极。
②阴极电极反应式为____________。
(5)流程中可循环利用的物质有________________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下下列溶液中的指定离子与100 mL 3.9 mol/L Ba(NO3)2溶液所含NO3-物质的量浓度相同的是
A.390 mL 0.1 mol/L MgCl2溶液中的Cl-
B.200 g 浓度为26%,密度为1.2g/mLNaOH溶液中的OH-
C.50 mL 7.8 mol/L Al2(SO4)3溶液中的SO42-
D.200 mL 3.9 mol/L CaCl2溶液中的Ca2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】抗痫灵(G)具有抗癫痫、抗惊厥、抗抑郁等功效,其合成路线如下图所示(某些反应条件和副产物已略):

(1)A中含氧官能团名称是______;简述证明A含有该官能团的实验方法:_________。
(2)若以醛基为母体,则B的系统命名法的名称为_______;①~⑥的反应中属于加成反应的是____ (填序号)。
(3)芳香化合物H是C的同分异构体,H的相关信息如下:
a.可发生银镜反应; b.可与NaHCO3溶液反应生成气体;c.苯环上的一溴代物有2种,则H的结构简式为__________。
(4)写出反应⑥的化学反应方程式:_____________。
(5)( )的单体是薰衣草的调和香料,以苯甲醛(
)的单体是薰衣草的调和香料,以苯甲醛(![]() )为起始原料(其余有机、无机原料任选),参照G的合成,设计并补充完成下列合成路线图:__________(空格内有几步,写几步。)
)为起始原料(其余有机、无机原料任选),参照G的合成,设计并补充完成下列合成路线图:__________(空格内有几步,写几步。)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(H2NNH2)是一种高能燃料,有关化学反应的能量变化如下图所示。已知断裂1 mol化学键所需的能量(kJ):N≡N为942、O=O为500、N—N为154,则断裂1 mol N—H键所需的能量(kJ)是:

A. 194 B. 391 C. 516 D. 658
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某合作学习小组的同学利用下列氧化还原反应设计原电池:2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O,盐桥中装有饱和![]() 溶液。下列叙述中正确的是
溶液。下列叙述中正确的是
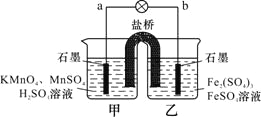
A. 甲烧杯中溶液的![]() 逐渐减小 B. 乙烧杯中发生还原反应
逐渐减小 B. 乙烧杯中发生还原反应
C. 外电路的电流方向是从![]() 到
到![]() D. 电池工作时,盐桥中的
D. 电池工作时,盐桥中的![]() 移向甲烧杯
移向甲烧杯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列氧化还原反应中,水只作为还原剂的是( )
A.3Fe+4H2O(g)![]() Fe3O4+4H2B.2H2O
Fe3O4+4H2B.2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
C.2Na2O2+2H2O═4NaOH+O2↑D.2F2+2H2O═4HF+O2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com