
| A、用鼻子对着盛有氯气的瓶口,就可以嗅到氯气的气味 |
| B、用排水集气法便可以收集到纯净的氯气 |
| C、干燥的氯气有漂白性 |
| D、自来水常用氯气来杀菌、消毒 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
 0.100 0mol/L的KOH标准溶液滴定未知浓度盐酸,其操作可分解为如下几步:
0.100 0mol/L的KOH标准溶液滴定未知浓度盐酸,其操作可分解为如下几步:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯气有毒,可以毒死细菌、病毒,所以可以用于自来水消毒 |
| B、新制氯水可使紫色石蕊试液先变红后褪色 |
| C、氯水光照时有气泡逸出,该气体的主要成分是氯气 |
| D、氯水放置数天后,其酸性逐渐减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将100g水倒入100g 98% 硫酸溶液中配制成49% 的硫酸溶液 |
| B、给试管里的液体加热时,液体体积不得超过试管容积的1/3 |
| C、使用胶头滴管时,应将滴管尖嘴伸进试管内,以免液体外流 |
| D、不小心将浓硫酸洒到桌面上,应先用抹布擦,再用大量水冲洗 |
查看答案和解析>>
科目:高中化学 来源: 题型:
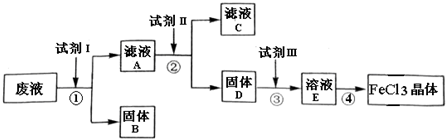
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com