
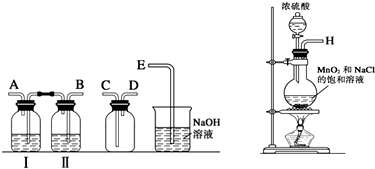
| 实验步骤 | 预期现象与结论 | |
| 步骤1 | 取少量上述漂白粉于试管中,先加入 | 若 若 |
| 步骤2 | 已确定漂白粉变质,则另取少量上述漂白粉于试管中,先加入适量1mol?L-1 HCl溶液,再加入 | 若 若 品红溶液褪色,则假设3成立. |
| 实验步骤 | 预期现象和结论 | |
| ① | 加入适量1mol/L盐酸溶解后,再将产生的气体导入到澄清石灰水中 | 若澄清石灰水未见浑浊,则假设1成立;若澄清石灰水变浑浊,则假设2或假设3成立 |
| ② | 向步骤①反应后的试管滴入1~2滴品红溶液,振荡 | 若品红不褪色,则假设2成立;若品红褪色,则假设3成立. |


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| X | 是植物生长的营养元素之一,也是蛋白质的重要组成元素 |
| Y | 地壳中含量居第一位 |
| Z | 短周期中其原子半径最大 |
| Q | 生活中大量使用其合金制品,工业上可用电解其氧化物的方法制备 |
| M | 海水中大量富集的元素之一,其最高正化合价与负价的代数和为6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如表所示.下列说法不正确的是
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如表所示.下列说法不正确的是| A、元素X与元素Z的最高正化合价之和的数值等于8 |
| B、离子Y2-和Z3+的核外电子数和电子层数均相同 |
| C、元素W的最高价氧化物对应的水化物的酸性比Q的弱 |
| D、元素X的气态氢化物的稳定性大于元素Y的气态氢化物的稳定性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2 mol SO2+1 mol O2 |
| B、4 mol SO2+1 mol O2 |
| C、2 mol SO2+1 mol O2+2 mol SO3 |
| D、3 mol SO2+1 mol SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
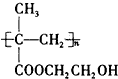 制成超薄镜片,其合成路线可以是:
制成超薄镜片,其合成路线可以是:
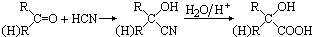
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | A | B | C | D |
| 强电解质 | KNO3 | H2SO4 | BaSO4 | HNO3 |
| 弱电解质 | HF | CaCO3 | HClO | NH3 |
| 非电解质 | SO2 | CS2 | H2O | C2H5OH |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、蒸馏、萃取、蒸发 |
| B、萃取、蒸馏、蒸发 |
| C、蒸发、萃取、蒸馏 |
| D、蒸发、蒸馏、萃取 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com