
【题目】青出于蓝而胜于蓝,“青”指的是靛蓝,是人类使用历史悠久的染料之一,下列为传统制备靛蓝的过程:

下列说法不正确的是( )
A. 靛蓝的分子式为C16H10N2O2
B. 浸泡发酵过程发生的反应为取代反应
C. 吲哚酚的苯环上的二氯代物有4种
D. 1 mol吲哚酚与H2加成时可消耗4 mol H2
科目:高中化学 来源: 题型:
【题目】在25℃、101kPa条件下,将15L O2通往10L CO和H2的混合气中,使其完全燃烧,干燥后,恢复至原来的温度和压强。
(1)若剩余气体的体积是15L,则原CO和H2的混合气体中,V(CO)=__________L,V(H2)=___________L。
(2)若剩余气体的体积为a L,则原CO和H2的混合气中,V(CO): V(H2)=_______。
(3)若剩余气体的体积为a L,则a的取值范围是_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空。
(1)在下列化学方程式中,双线桥法标出电子转移并填空。3S+6KOH![]() K2SO3+2K2S+3H2O___,氧化剂___,还原剂___;2KMnO4+16HCl(浓)=2KCl+2MnCl2+8H2O+5Cl2↑___,氧化剂___,被氧化的物质_____;3Cu+8HNO3=3Cu(NO3)2+2NO+4H2O___,被还原的物质_____,还原剂______。
K2SO3+2K2S+3H2O___,氧化剂___,还原剂___;2KMnO4+16HCl(浓)=2KCl+2MnCl2+8H2O+5Cl2↑___,氧化剂___,被氧化的物质_____;3Cu+8HNO3=3Cu(NO3)2+2NO+4H2O___,被还原的物质_____,还原剂______。
(2)请把符合要求的化学反应方程式的编号填入括号内:是分解反应又是氧化还原反应的是___,是分解反应不是氧化还原反应的是___,是化合反应又是氧化还原反应的是___,是化合反应不是氧化还原反应的是___,不属于四种基本反应类型的氧化还原反应的是___。
A.2KClO3![]() 2KCl+3O2↑ B.2Fe+3Cl2
2KCl+3O2↑ B.2Fe+3Cl2![]() 2FeCl3 C.NH4HCO3
2FeCl3 C.NH4HCO3![]() NH3↑+H2O+CO2↑D.CaO+CO2=CaCO3 E.Cl2+H2O=HCl+HClO
NH3↑+H2O+CO2↑D.CaO+CO2=CaCO3 E.Cl2+H2O=HCl+HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在K2Cr2O7溶液中存在如下平衡:Cr2O72-(橙色)+H2O![]() 2CrO42-(黄色)+2H+。向K2Cr2O7溶液中加入X溶液,可使溶液变黄,下列说法一定不正确的是
2CrO42-(黄色)+2H+。向K2Cr2O7溶液中加入X溶液,可使溶液变黄,下列说法一定不正确的是
A. 加入X溶液,上述平衡正向移动
B. Cr2O72-的物质的量浓度增大
C. X溶液可能是NaOH溶液
D. 再加入H2SO4,可使黄色溶液变为橙色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某地海水中主要离子的含量如下表,现利用“电渗析法”进行淡化,技术原理如图所示(两端为惰性电极,阳膜只允许阳离子通过,阴膜只允许阴离子通过)。下列有关说法错误的是
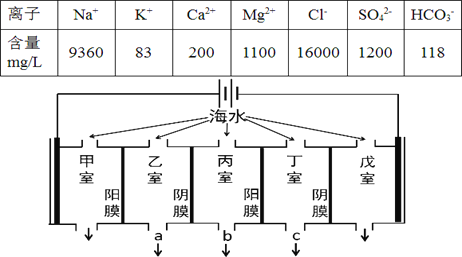
A. 甲室的电极反应式为:2Cl--2e-= Cl2↑
B. 淡化过程中易在戊室形成水垢
C. 乙室和丁室中部分离子的浓度增大,淡水的出口为 b
D. 当戊室收集到22.4L(标准状况)气体时,通过甲室阳膜的离子的物质的量一定为2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将足量的BaSO4固体溶于50 mL水中,充分搅拌,慢慢加入Na2CO3固体,随着c(![]() )增大,溶液中c(Ba2+)的变化曲线如图所示。则下列说法正确的是
)增大,溶液中c(Ba2+)的变化曲线如图所示。则下列说法正确的是

A. 该温度下Ksp(BaSO4)>Ksp(BaCO3)
B. 加入Na2CO3固体,立即有BaCO3固体生成
C. BaCO3的Ksp=2.5×10-10
D. 曲线BC段内,c(![]() )∶c(
)∶c(![]() )=25
)=25
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图1为“镁﹣次氯酸盐”燃料电池原理示意图。图2为“双极室成对电解法”生产乙醛酸原理示意图,该装置中阴、阳两极为惰性电极,两极室均可产生乙醛酸,其中乙二醛与M电极的产物反应生成乙醛酸。下列说法不正确的是

A. 若利用镁燃料电池为电源,则E极连M极
B. 镁燃料电池负极容易与水发生自腐蚀产生氢气
C. F电极上的电极反应式为ClO-+2e-+H2O=Cl-+2OH-
D. 图2装置中若有2 mol H+通过质子交换膜完全反应,则共生成2 mol乙醛酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是化学实验室及化工生产中的重要物质,应用广泛。
(1)已知25℃时:N2(g)+O2(g)![]() 2NO(g) △H1=+183kJ/mol
2NO(g) △H1=+183kJ/mol
2H2(g)+O2(g)=2H2O(1) △H2=-571.6kJ/mol
4NH3(g)+5O2(g)=4NO(g)+6H2O(1) △H3=-1164.4kJ/mol
则N2(g)+3H2(g)![]() 2NH3(g) △H=________kJ/mol
2NH3(g) △H=________kJ/mol
(2)在恒温恒容密闭容器中进行合成氨反应,起始投料时各物质浓度如下表:
N2 | H2 | NH3 | |
投料I | 1.0mol/L | 3.0mol/L | 0 |
投料II | 0.5mol/L | 1.5mol/L | 1.0mol/L |
①按投料I进行反应,测得达到化学平衡状态时H2的转化率为40%,若按投料II进行反应,起始时反应进行的方向为________(填“正向”或“逆向”)。
②L(L1、L2)、X可分别代表压强或温度。如图表示L一定时,合成氨反应中H2(g)的平衡转化率随X
的变化关系。
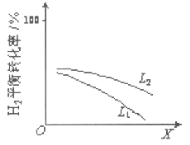
iX代表的物理量是_________,
ii判断L1、L2的大小关系,并简述理由:_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com