
【题目】(1)过渡金属元素铁能形成多种配合物,如:[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(Ⅲ)]和Fe(CO)x等。
①基态Fe3+的M层电子排布式为__________________。
②配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x=_________。Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于__________(填晶体类型)
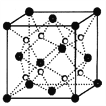
(2)O和Na形成的一种只含有离子键的离子化合物的晶胞结构如图,距一个阴离子周围最近的所有阳离子为顶点构成的几何体为__________。已知该晶胞的密度为ρg/cm3,阿伏加德罗常数为NA,求晶胞边长a=__________cm。(用含ρ、NA的计算式表示)
(3)下列说法正确的是__________。
A.第一电离能大小:S>P>Si
B.电负性顺序:C<N<O<F
C.因为晶格能CaO比KCl高,所以KCl比CaO熔点低
D.SO2与CO2的化学性质类似,分子结构也都呈直线型,相同条件下SO2的溶解度更大
E.分子晶体中,共价键键能越大,该分子晶体的熔沸点越高
(4)图1是:Na、Cu、Si、H、C、N等元素单质的熔点高低的顺序,其中c、d均是热和电的良导体。

①图中d单质的晶体堆积方式类型是______________________。
②图2是上述六种元素中的一种元素形成的含氧酸的结构,请简要说明该物质易溶于水的原因:__________________________。
【答案】 3s23p63d5 5 分子晶体 立方体  BC 面心立方最密堆积 硝酸分子是极性分子,易溶于极性溶剂的水中,硝酸分子中氢氧键易与水分子间形成氢键
BC 面心立方最密堆积 硝酸分子是极性分子,易溶于极性溶剂的水中,硝酸分子中氢氧键易与水分子间形成氢键
【解析】(1)①Fe原子核外有26个电子,核外电子排布为1s22s22p63s23p63d64s2,Fe原子失去4s能级2个电子、3d能级1个电子形成Fe3+,Fe3+电子排布式为1s22s22p63s23p63d5 ,则M层电子排布式为:3s23p63d5,故答案为:3s23p63d5;
②配合物Fe(CO)x的中心原子是铁原子,其价电子数是8,每个配体提供的电子数是2,8+2x=18,x=5,分子晶体的熔沸点较低,根据题给信息知,该物质的熔沸点较低,所以为分子晶体,故答案为:5;分子晶体;
(2)距一个阴离子周围最近的所有阳离子为顶点构成的几何体是立方体,该晶胞中钠离子个数是8,氧离子个数=8/8+6/2=4,V=m/ρ=248/ρNAcm3,则a= ,故答案为:立方体;
,故答案为:立方体;  ;
;
(3)A.同一周期元素中,元素的第一电离能随着原子序数的增大呈增大趋势,但第VA族元素的第一电离能大于相邻元素,所以第一电离能大小:P>S>Si,故A错误;B.同一周期元素中,元素的电负性随着原子序数的增大而增大,所以电负性顺序:C<N<O<F,故B正确;C.晶格能与离子晶体的熔点成正比,离子半径与晶格能成反比,离子所带电荷与晶格能成正比,钙离子电荷大于钾离子,且钙离子半径小于钾离子,氯离子所带电荷小于氧离子,且氯离子半径大于氧离子,所以氯化钾的晶格能小于氧化钙,则氯化钾的熔点比氧化钙低,故C正确;D.二氧化硫分子中硫原子的价层电子对是3且含有一个电子对,所以二氧化硫是V形结构,为极性分子,二氧化碳是非极性分子,根据相似相溶原理知,二氧化硫易溶于水,故D错误;E.分子晶体中,物质的熔沸点与其相对分子质量成正比,故D错误;故选BC;
(4)①d单质是热和电的良导体,且熔点较高,则为铜,铜为面心立方最密堆积,故答案为:面心立方最密堆积;
②根据图知,该分子中含有一个氢原子、三个氧原子和一个氮原子,为硝酸分子,硝酸分子正负电荷重心不重合,为极性分子,且硝酸和水能形成氢键而增大硝酸的溶解性,故答案为:硝酸分子是极性分子,易溶于极性溶剂的水中,硝酸分子中氢氧键易与水分子间形成氢键。


科目:高中化学 来源: 题型:
【题目】用1L1.0mol·L-1的NaOH溶液吸收0.6molCO2,所得溶液中的CO32-和HCO3-的物质的量浓度之比约是( )
A.1∶3B.2∶1C.2∶3D.3∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,水的电离程度相同
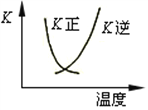
B. 2SO2(g) + O2(g)![]() 2SO3(g)的正、逆反应的平衡常数K随温度的变化可用上图表示
2SO3(g)的正、逆反应的平衡常数K随温度的变化可用上图表示
C. 2NO+2CO![]() 2CO2+N2 的ΔH<0,常温下该反应一定能自发进行
2CO2+N2 的ΔH<0,常温下该反应一定能自发进行
D. 25°C时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.1 mol O2和1 mol N2所占的体积都约为22.4 L
B.H2的气体摩尔体积约为22.4 L
C.在标准状况下,1 mol H2和1 mol H2O所占的体积都约为22.4 L
D.在标准状况下,22.4 L由N2、N2O组成的混合气体中所含有的N的物质的量约2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】多酶片中含有蛋白酶、淀粉酶和脂肪酶,具有辅助消化的作用.其片剂是糖衣片,这样制作的目的是( )
A. 补充体内糖类物质的供给
B. 防止胃液的消化
C. 经唾液消化后即可迅速起作用
D. 使其中各种酶缓慢的起作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.同温同压下甲烷和氧气的密度之比为2:1
B.1 g甲烷和1 g氧气的原子数之比为5:1
C.等物质的量的甲烷和氧气的质量之比为2:1
D.在标准状况下等质量的甲烷和氧气的体积之比为1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
下列有关元素与化合物的叙述,正确的是( )
A. 糖类和脂质的组成元素都是C、H、O
B. 自由水是细胞结构的重要成分
C. 淀粉和糖原都是细胞内的储能物质
D. RNA是细胞内的遗传物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验事实与硝酸性质不相对应的一组是( )
A. 浓硝酸使紫色石蕊溶液先变红后退色——酸性和强氧化性
B. 铁与稀硝酸反应不能放出氢气——强氧化性
C. 要用棕色瓶盛装浓硝酸——不稳定性
D. 氢氧化亚铁固体与稀硝酸混合——仅强酸性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com