
【题目】二甲醚(CH3OCH3)是重要的能源物质,其制备、应用与转化是研究的热点。
(1) 利用合成气制备二甲醚主要包含三个反应:
CO(g)+2H2(g)=CH3OH(g);ΔH=-90.4 kJ·mol-1
2CH3OH(g)=CH3OCH3(g)+H2O(g);ΔH=-23.4 kJ·mol-1
CO(g) +H2O(g)=H2(g)+CO2(g);ΔH=-41.0 kJ·mol-1
则3CO(g)+3H2(g)=CH3OCH3(g)+CO2(g);ΔH=________。
(2) 某二甲醚/双氧水燃料电池的工作原理如图1所示。电池工作时,电极A附近溶液pH________(填“减小”“增大”或“不变”);电极B的电极反应式为_____________。

(3) 二甲醚催化羰化制备乙醇主要涉及以下两个反应:
反应Ⅰ:CO(g)+CH3OCH3(g)=CH3COOCH3(g);ΔH1
反应Ⅱ:CH3COOCH3(g)+2H2(g)=CH3CH2OH(g)+CH3OH(g);ΔH2
反应Ⅰ、Ⅱ的平衡常数的对数lg K1、lg K2与温度的关系如图2所示;在固定CO、CH3OCH3、H2的原料比、体系压强不变的条件下,同时发生反应Ⅰ、Ⅱ,平衡时各物质的物质的量分数随温度的变化如图3所示。
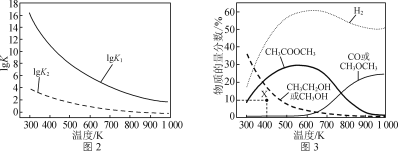
① ΔH1________(填“>”“<”或“=”)0。
②300~400 K时,CH3CH2OH物质的量分数随温度升高而降低的原因是________。
③ 600~700 K时,CH3COOCH3物质的量分数随温度升高而降低的原因是________。
④ 400 K时,在催化剂作用下,反应一段时间后,测得CH3CH2OH物质的量分数为10%(图3中X点)。不改变原料比、温度和压强,一定能提高CH3CH2OH物质的量分数的措施有________________________。
【答案】-245.2 kJ·mol1 增大 CH3OCH3-12e-+16OH-=2CO32+11H2O < 由图2知,此温度范围内反应Ⅰ较完全;温度升高,反应Ⅱ平衡左移,导致CH3CH2OH物质的量分数降低 温度升高,反应Ⅰ平衡左移超过反应Ⅱ平衡左移的幅度 延长反应时间、使用对反应Ⅱ催化性能更好的催化剂
【解析】
(1)利用盖斯定律进行计算。
(2)根据电极的反应分析溶液中酸性变化,电极B是CH3OCH3在碱性条件下生成碳酸根。
(3)①根据温度变化,平衡常数的变化得出反应热量变化;②300~400 K时,根据图像中的信息及两个反应的主次来进行分析;③600~700 K时,根据分析两个反应都是放热反应,再根据图3中各物质的曲线变化分析。
(1)利用盖斯定律将第1个方程式乘以2加上第2个方程式,再加上第三个方程式则3CO(g)+3H2(g)=CH3OCH3(g)+CO2(g);ΔH=-245.2 kJ·mol1;故答案为:-245.2 kJ·mol1。
(2)某二甲醚/双氧水燃料电池的工作原理如图1所示。电池工作时,电极A是H2O2失去电子和磷酸反应,因此电极A附近溶液酸性减弱,溶液pH增大;电极B的电极反应式为CH3OCH3-12e-+16OH-=2CO32+11H2O;故答案为:增大;CH3OCH3-12e-+16OH-=2CO32+11H2O。
(3)①升高温度,lgK1减小,则K1减小,说明平衡逆向移动,逆向是吸热反应,正向放热反应,即ΔH1 < 0;故答案为:<。
②300~400 K时,CH3CH2OH物质的量分数随温度升高而降低的原因是由图2知,此温度范围内反应Ⅰ较完全;温度升高,反应Ⅱ平衡左移,导致CH3CH2OH物质的量分数降低;故答案为:由图2知,此温度范围内反应Ⅰ较完全,温度升高,反应Ⅱ平衡左移,导致CH3CH2OH物质的量分数降低。
③600~700 K时,根据分析两个反应都是放热反应,再根据图3中各物质的曲线变化得到CH3COOCH3物质的量分数随温度升高而降低的原因是温度升高,反应Ⅰ平衡左移超过反应Ⅱ平衡左移的幅度;故答案为:温度升高,反应Ⅰ平衡左移超过反应Ⅱ平衡左移的幅度。
④400 K时,在催化剂作用下,反应一段时间后,测得CH3CH2OH物质的量分数为10%,不改变原料比、温度和压强,一定能提高CH3CH2OH物质的量分数的措施有延长反应时间、使用对反应Ⅱ催化性能更好的催化剂;故答案为:延长反应时间、使用对反应Ⅱ催化性能更好的催化剂。


科目:高中化学 来源: 题型:
【题目】有一镁、铝合金,用适量稀硫酸恰好完全溶解,再加入氢氧化钠溶液,析出沉淀的物质的量随氢氧化钠的体积关系如图所示,则原合金中镁、铝物质的量之比为( )
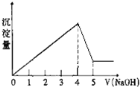
A. 1:1B. 2:1C. 3:1D. 1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源短缺是人类社会面临的重大问题,甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)已知:CO、H2、CH3OH(g)的燃烧热分别为283kJ/mol、285.8kJ/mol、768kJ/mol。工业上一般利用合成气发生下列反应合成甲醇:CO(g)+ 2H2(g)![]() CH3OH(g)。
CH3OH(g)。
①完成该热化学方程式:CO(g)+ 2H2(g)![]() CH3OH(g)△H=______ kJ/mol;
CH3OH(g)△H=______ kJ/mol;
②某温度下,将2mol CO和6mol H2充入2L的密闭容器中,达到平衡,测得c(H2)= 2.2molL﹣1,则CO的转化率为______。
(2)T1℃时,此反应的平衡常数为K(T1)= 50。此温度下,在一个2L的密闭容器中加入一定量CO和H2,反应到某时刻测得各组分的浓度如下:
物质 | H2 | CO | CH3OH(g) |
浓度/(molL﹣1) | 0.2 | 0.2 | 0.4 |
①比较此时正、逆反应速率的大小:v正____v逆值(填“>”、“<”或“=”)。
②若其他条件不变,在T2℃反应l0min后又达到平衡,测得n(H2)= 0.3mol,试比较:温度T1___T2(填“>”、“=”或“<”,下同)T2℃时该反应的平衡常数K(T2)______50。
③若其他条件不变时,只改变反应的某一个条件,下列说法正确的是______。
a.若达到新平衡时c(CO)= 0.3mo1/L,平衡一定逆向移动
b.若将容器体积缩小到原来的一半,达到新平衡时,0.2mol/L<c(CO)<0.4mol/L
c.若向容器中同时加入0.4mol CO和0.8mol CH3OH(g),平衡不移动
d.若向容器中加入0.8mol CH3OH(g),达到新平衡时,CO的体积分数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A.Fe与稀盐酸反应:2Fe+6H+=2Fe3++3H2↑
B.向K2CO3溶液中通入过量SO2:CO![]() +2SO2+H2O=CO2+2HSO
+2SO2+H2O=CO2+2HSO![]()
C.在强碱溶液中NaClO与FeCl3反应生成Na2FeO4:3ClO-+2Fe3++5H2O=2 FeO![]() +3Cl-+10H+
+3Cl-+10H+
D.用新制的Cu(OH)2检验乙醛中的醛基:CH3CHO+Cu(OH)2+OH-![]() CH3COO-+Cu+2H2O
CH3COO-+Cu+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将物质X逐渐加入Y溶液中,生成沉淀物质的量n2与所加X的物质的量n1的关系如图所示。符合图所示情况的是
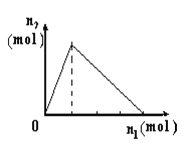
A | B | C | D | |
X | NaOH | AlCl3 | HCl | NaAlO2 |
Y | AlCl3 | NaOH | NaAlO2 | HCl |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】小颖同学用如图所示装置研究原电池原理,下列说法错误的是( )

A.若将图1装置的Zn、Cu直接接触,Cu片上能看到气泡产生
B.图2装置中![]() 向Cu片移动
向Cu片移动
C.若将图2中的Zn片改为Mg片,Cu片上产生气泡的速率加快
D.图2与图3中正极生成物的质量比为1:32时,Zn片减轻的质量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对于实验装置的有关说法错误的是( )
A.装置Ⅰ:可以用来验证碳的非金属性比硅强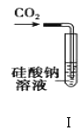
B.装置Ⅱ:可以用来比较Na2CO3和NaHCO3的热稳定性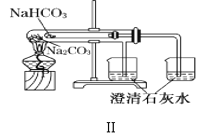
C.装置Ⅲ:先从①口进气收集满二氧化碳,再从②口进气,则可收集NO气体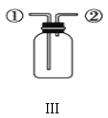
D.装置Ⅳ:可以用于制备Fe(OH)2并能保证相对较长时间观察到白色沉淀Fe(OH)2 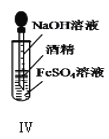
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是一种实验某气体化学性质的实验装置,图中B为开关。如先打开B,在A处通入干燥的氯气,C中红色布条颜色无变化;当关闭B时,C处红色布条褪色。则D瓶中盛有的溶液是( )

A. 浓硫酸B. 饱和氯化钠溶液C. 浓氢氧化钠溶液D. 氢氧化钙悬浊液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4 mol A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g)2C(g)。若经2 s时测得C的浓度为0.6 mol·L-1,填写下列空白:
(1)用物质A表示反应的平均速率为_________。
(2)用物质B表示反应的平均速率为_________。
(3)2 s时物质A的转化率为_________。
(4)2 s时物质B的体积分数为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com