
【题目】能源短缺是人类社会面临的重大问题,甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)已知:CO、H2、CH3OH(g)的燃烧热分别为283kJ/mol、285.8kJ/mol、768kJ/mol。工业上一般利用合成气发生下列反应合成甲醇:CO(g)+ 2H2(g)![]() CH3OH(g)。
CH3OH(g)。
①完成该热化学方程式:CO(g)+ 2H2(g)![]() CH3OH(g)△H=______ kJ/mol;
CH3OH(g)△H=______ kJ/mol;
②某温度下,将2mol CO和6mol H2充入2L的密闭容器中,达到平衡,测得c(H2)= 2.2molL﹣1,则CO的转化率为______。
(2)T1℃时,此反应的平衡常数为K(T1)= 50。此温度下,在一个2L的密闭容器中加入一定量CO和H2,反应到某时刻测得各组分的浓度如下:
物质 | H2 | CO | CH3OH(g) |
浓度/(molL﹣1) | 0.2 | 0.2 | 0.4 |
①比较此时正、逆反应速率的大小:v正____v逆值(填“>”、“<”或“=”)。
②若其他条件不变,在T2℃反应l0min后又达到平衡,测得n(H2)= 0.3mol,试比较:温度T1___T2(填“>”、“=”或“<”,下同)T2℃时该反应的平衡常数K(T2)______50。
③若其他条件不变时,只改变反应的某一个条件,下列说法正确的是______。
a.若达到新平衡时c(CO)= 0.3mo1/L,平衡一定逆向移动
b.若将容器体积缩小到原来的一半,达到新平衡时,0.2mol/L<c(CO)<0.4mol/L
c.若向容器中同时加入0.4mol CO和0.8mol CH3OH(g),平衡不移动
d.若向容器中加入0.8mol CH3OH(g),达到新平衡时,CO的体积分数不变
【答案】-86.6 40% = > > bc
【解析】
(1) ①三种物质燃烧的热化学方程式为:
H2(g)+1/2O2(g)=H2O(l) H=-285.8kJ/mol ①
CO(g)+1/2O2(g)=CO2(g) H=-283.0kJ/mol ②
CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(l) H=-768kJ/mol ③
则①×2+②-③得:CO(g)+2H2(g)![]() CH3OH(g) △H=-86.6kJ/mol。
CH3OH(g) △H=-86.6kJ/mol。
②设CO的变化量为x mol/L
CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
起始量 1 3 0
变化量 x 2x x
平衡量 1-x 3-2x x
则3-2x=2.2,即x=0.4
CO的转化率为![]() 。
。
(2)①浓度商![]() ,说明反应达到平衡状态,所以v正=v逆。
,说明反应达到平衡状态,所以v正=v逆。
②若其他条件不变,在T2℃反应l0min后又达到平衡,测得n(H2)=0.3mol,则其浓度为0.15mol/L,与原平衡相比较氢气浓度减小,可得出平衡正向移动。对于放热反应,温度降低,平衡正向移动,从而得出T1>T2;T2℃时平衡正向移动,则该反应的平衡常数增大,K(T2)>50;
③若其他条件不变时,只改变反应的某一个条件
a.达到新平衡时c(CO)=0.3mo1/L,若为增大CO的浓度,平衡会正向移动,错误;
b.若将容器体积缩小到原来的一半,CO的浓度变为原来的2倍,达到新平衡时,浓度减小,但比原平衡时大,故0.2mol/L<c(CO)<0.4mol/L,正确;
c.若向容器中同时加入0.4mol CO和0.8mol CH3OH(g),利用浓度商进行分析,平衡不移动,正确;
d.因起始投入量之比不等于化学计量数之比,若向容器中加入0.8mol CH3OH(g),不是等效平衡,所以达到新平衡时,CO的体积分数改变,错误。
故答案为bc。


科目:高中化学 来源: 题型:
【题目】现有金属单质A、B、C和气体甲、乙、丙以及物质D、E、F、G、H,它们之间的相互转化关系如图所示(图中有些反应的生成物和反应的条件没有标出)。
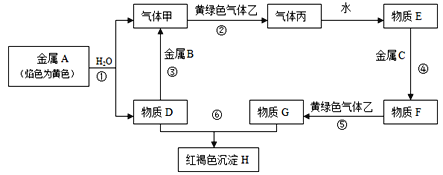
请回答下列问题:
(1)写出下列物质的化学式:B_____________, C_______________,F_____________, 乙_______________,
(2)写出下列反应的离子方程式:反应①____________________;反应⑤____________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某铁的氧化物粉末可能含有FeO、Fe2O3中的一种或两种。某化学兴趣小组为验证该氧化物粉末的组成,做了如下实验:
(1)甲同学利用1mol/L的硫酸、KSCN溶液、酸性高锰酸钾溶液来确定其组成
编号 | 实验操作 | 实验现象与结论 |
① | 取少量粉末放入试管中,注入1mol/L的硫酸 | 粉末逐渐溶解,溶液呈黄绿色 |
② | 将①中所得溶液分成两份,向其中一份滴加几滴__________,振荡 | 若溶液________ ,说明有Fe2O3存在 |
③ | 向另一份溶液中加入少量__________,振荡 | 若溶液________ ,说明有FeO存在 |
(2)乙同学称取30.4g固体,按以下步骤进行实验:
步骤一 将固体置于烧杯中,加入1mol/L的硫酸将固体完全溶解
步骤二 往烧杯中先加入足量的氯水,充分反应后再加入足量的氢氧化钠溶液
步骤三 将步骤二所得的物质过滤洗涤后,灼烧至固体质量不再变化,得到32g红棕色固体
①步骤二中加入氯水的目的是__________________________________________;
②步骤三中沉淀洗涤的操作为__________________________________________;
③原固体中FeO和Fe2O3的物质的量之比为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室探究SO2与Fe(NO3)3溶液反应的原理,装置如下图,实验中Y装置产生白色沉淀。下列说法不正确的是
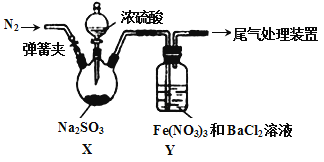
A. 滴加浓硫酸之前应进行的操作是打开弹簧夹,通入一段时间N2
B. Y中产生的白色沉淀是BaSO4或BaSO3
C. 产生白色沉淀的原因可能是在酸性条件下SO2与NO3- 反应生成了SO42-
D. 若将Fe(NO3)3换成FeCl3,Y中也能产生白色沉淀,说明Fe3+也能将SO2氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据有关媒体报道,美国华裔科学家叶军领导一个研究小组成功制造出全球最准确的时钟,两亿年误差不足一秒。它是一个锶原子钟,比铯原子喷泉钟准确得多,估计将可大大促进不同的电讯网络的发展,将使全球各地的船只导航变得更为准确。请根据锶、铯在元素周期表中的位置,推断下列内容:
(1)锶元素属于________(填“金属”或“非金属”)元素,金属性比钙元素________(填“强”或“弱”),锶原子的核内质子数为________,原子核外有________个电子层,其原子结构示意图为________,其原子半径________镁(填“大于”、“小于”或“等于”);铯的原子核外共有________层电子,最外层电子数为________。
(2)铯与水起剧烈反应,放出________色气体,同时使滴有紫色石蕊试液的溶液显________色,因为______________________(写出化学方程式)。
(3)碳酸锶是________色粉末,与盐酸反应的离子方程式为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烟气的脱硝(除![]() )技术和脱硫(除
)技术和脱硫(除![]() )技术都是目前环境科学研究的热点。
)技术都是目前环境科学研究的热点。
(1)工业上可以采用“质子膜电解槽”对烟气进行脱硫脱硝,其工艺如图甲所示:
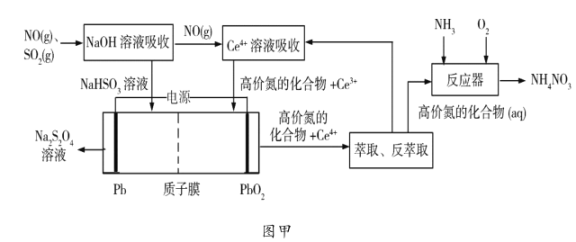
①![]() 溶液吸收
溶液吸收![]() 主要反应的化学方程式为___________;
主要反应的化学方程式为___________;
②电解的主要目的是______________,阴极的电极反应式为______________;
③“高价氮的化合物”中NO2在反应器中发生化合反应的化学方程式为______;
(2)利用活性焦炭的吸附作用,可以对烟气进行脱硫和脱硝。被吸附的![]() 与活性焦炭反应生成
与活性焦炭反应生成![]() 和
和![]() ,当生成
,当生成![]() 时,转移电子的物质的量为__________
时,转移电子的物质的量为__________![]() ;
;
(3)一定条件下,将一定浓度NOx(NO2和NO的混合气体)通入![]() 的
的![]() 乳浊液中,发生的反应如下:
乳浊液中,发生的反应如下:![]() ,
,![]() ,改变
,改变![]() ,
,![]() 的去除率变化情况如图乙所示。
的去除率变化情况如图乙所示。
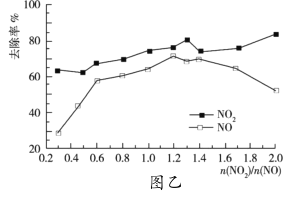
①当![]() 大于1.4时,
大于1.4时,![]() 去除率升高,但
去除率升高,但![]() 的去除率却降低。其可能的原因是__;
的去除率却降低。其可能的原因是__;
②![]() 和
和![]() 发生的主要反应为
发生的主要反应为![]() 。保持
。保持![]() 的初始浓度不变,改变
的初始浓度不变,改变![]() ,将反应后的混合气体通入
,将反应后的混合气体通入![]() 乳浊液中吸收。为节省
乳浊液中吸收。为节省![]() 的用量,又能保持
的用量,又能保持![]() 去除效果,则
去除效果,则![]() 合适的值约为___________;
合适的值约为___________;
(4)已知:![]() ,
,![]() ,则
,则![]() ______________________。
______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛酸钡(BaTiO3)是电子陶瓷器件的重要基础原料。工业上以钛精矿(主要成分为TiO2)和BaCl2为主要原料制备钛酸钡粉体的工艺流程如下:

已知:①TiCl4水解生成H2TiO3沉淀;
②水溶液中含碳微粒随pH的分布如图所示。

(1) “氯化”在800 ℃时进行,其反应的化学方程式为________。
(2) “共沉淀”时,需控制溶液pH为10~11,其原因是:①___________;② ________。
(3) “滤液”中溶质的主要成分为________(填化学式)。过滤得到的固体通常用一定浓度的NH4HCO3溶液进行洗涤,其主要原因是___________。
(4) “煅烧”得到的钛酸钡粉体中钡钛质量比![]() ,钛酸钡粉体中可能含有的杂质为____________(填化学式)。
,钛酸钡粉体中可能含有的杂质为____________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚(CH3OCH3)是重要的能源物质,其制备、应用与转化是研究的热点。
(1) 利用合成气制备二甲醚主要包含三个反应:
CO(g)+2H2(g)=CH3OH(g);ΔH=-90.4 kJ·mol-1
2CH3OH(g)=CH3OCH3(g)+H2O(g);ΔH=-23.4 kJ·mol-1
CO(g) +H2O(g)=H2(g)+CO2(g);ΔH=-41.0 kJ·mol-1
则3CO(g)+3H2(g)=CH3OCH3(g)+CO2(g);ΔH=________。
(2) 某二甲醚/双氧水燃料电池的工作原理如图1所示。电池工作时,电极A附近溶液pH________(填“减小”“增大”或“不变”);电极B的电极反应式为_____________。

(3) 二甲醚催化羰化制备乙醇主要涉及以下两个反应:
反应Ⅰ:CO(g)+CH3OCH3(g)=CH3COOCH3(g);ΔH1
反应Ⅱ:CH3COOCH3(g)+2H2(g)=CH3CH2OH(g)+CH3OH(g);ΔH2
反应Ⅰ、Ⅱ的平衡常数的对数lg K1、lg K2与温度的关系如图2所示;在固定CO、CH3OCH3、H2的原料比、体系压强不变的条件下,同时发生反应Ⅰ、Ⅱ,平衡时各物质的物质的量分数随温度的变化如图3所示。
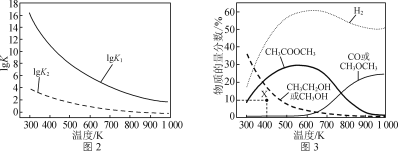
① ΔH1________(填“>”“<”或“=”)0。
②300~400 K时,CH3CH2OH物质的量分数随温度升高而降低的原因是________。
③ 600~700 K时,CH3COOCH3物质的量分数随温度升高而降低的原因是________。
④ 400 K时,在催化剂作用下,反应一段时间后,测得CH3CH2OH物质的量分数为10%(图3中X点)。不改变原料比、温度和压强,一定能提高CH3CH2OH物质的量分数的措施有________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与社会、生活密切相关。下列事实和解释均正确的是( )
选项 | 事实 | 解释 |
A | 单晶硅用于制造光导纤维 | 单晶硅可使光发生全反射 |
B | 泡沫灭火器是利用 |
|
C | 利用铝热剂( | 铝置换出铁吸收能量使铁凝固 |
D | 用乙醇洗去织物上的油污 | 乙醇能与油污发生取代反应 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com