
【题目】现有金属单质A、B、C和气体甲、乙、丙以及物质D、E、F、G、H,它们之间的相互转化关系如图所示(图中有些反应的生成物和反应的条件没有标出)。
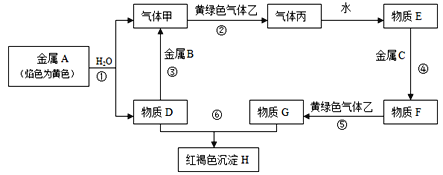
请回答下列问题:
(1)写出下列物质的化学式:B_____________, C_______________,F_____________, 乙_______________,
(2)写出下列反应的离子方程式:反应①____________________;反应⑤____________________;
【答案】Al Fe FeCl2 Cl2 2Na + 2H2O = 2Na+ + 2OH- + H2↑ 2Fe2+ + Cl2 = 2Fe3+ + 2Cl-
【解析】
金属A颜色反应为黄色证明为Na,与水反应生成气体甲为H2,D为NaOH,金属B和氢氧化钠溶液反应生成氢气,说明B为Al,黄绿色气体乙为Cl2,与氢气反应生成丙为HCl,溶于水得到E为盐酸,物质D(氢氧化钠)和G为反应生成红褐色沉淀H为Fe(OH)3,说明G中含有Fe3+,金属C与盐酸反应得到F,F与氯气反应得到G,可推知,C为Fe,F为FeCl2,G为FeCl3,然后结合物质的性质及化学用语来解答。
(1)根据分析可知B为Al,C为Fe,F为FeCl2,乙为Cl2,故答案为:Al;Fe;FeCl2;Cl2;
(2)反应①为钠与水的反应,该反应的离子方程式为:2Na+2H2O=2Na++2OH-+H2↑;反应⑤为氯化亚铁与氯气反应生成氯化铁,该反应的离子方程式为:2Fe2++Cl2=2Cl-+2Fe3+,故答案为:2Na+2H2O=2Na++2OH-+H2↑;2Fe2++Cl2=2Cl-+2Fe3+。


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:
【题目】氢卤酸的能量关系如图所示下列说法正确的是
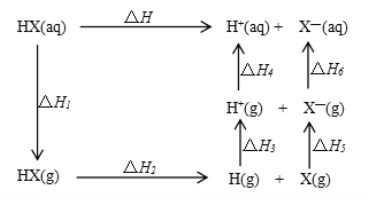
A. 已知HF气体溶于水放热,则HF的△H1<0
B. 相同条件下,HCl的△H2比HBr的小
C. 相同条件下,HCl的△H3+△H4比HI的大
D. 一定条件下,气态原子生成1molH-X键放出akJ能量,则该条件下△H2=+akJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式中正确的是
A.碳酸氢铵溶液与足量的NaOH溶液混合后加热:NH4++OH-![]() NH3↑+H2O
NH3↑+H2O
B.Ca(HCO3)2溶液中滴加少量NaOH溶液 Ca2++HCO3-+OH-=CaCO3↓+H2O
C.NaHSO4溶液和Ba(OH)2溶液充分反应后溶液呈中性:Ba2++OH-+H++SO42-=BaSO4↓+H2O
D.向Fe(OH)2中加入稀硝酸:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)0.5mol CH4的质量是_____g,在标准状况下的体积为______L;含有约______个氢原子。
(2)将标准状况下22.4L的HCl溶于水配成200mL的溶液,所得溶液的物质的量浓度为______;配制300mL 0.5molL﹣1氯化钠溶液,需要1.5molL﹣1的氯化钠溶液的体积是______mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
(1)写出下列仪器的名称:
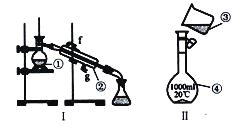
①__________________;②__________________;④__________________;
(2)仪器①~④中,使用时必须检査是否漏水的有_______________(填序号〉
(3)现需配制250 mL0.2mol/LNaCl溶液,装置II是某同学转移溶液的示意图,图中两处错误是_____________,___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物M的结构结构简式如图所示。关于M,下列说法正确的是( )
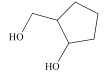
A.分子中所有碳原子可能共平面
B.M的同分异构体中,能与饱和NaHCO3溶液反应有9种
C.可使酸性高锰酸钾溶液褪色
D.1molM与足量的钠反应可以生成22.4LH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将含amol金属钠和bmol金属铝的合金投入mg足量水中,完全溶解,无金属剩余,所得溶液密度为dgcm﹣3,下列相关计算式子中错误的是( )
A.NaOH的物质的量:(a﹣b)mol
B.NaAlO2的物质的量浓度:![]() mol/L
mol/L
C.标况下生成H2的体积:![]() L
L
D.参加反应的水的质量:18(a+1.5b)g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一镁、铝合金,用适量稀硫酸恰好完全溶解,再加入氢氧化钠溶液,析出沉淀的物质的量随氢氧化钠的体积关系如图所示,则原合金中镁、铝物质的量之比为( )
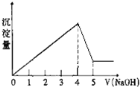
A. 1:1B. 2:1C. 3:1D. 1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源短缺是人类社会面临的重大问题,甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)已知:CO、H2、CH3OH(g)的燃烧热分别为283kJ/mol、285.8kJ/mol、768kJ/mol。工业上一般利用合成气发生下列反应合成甲醇:CO(g)+ 2H2(g)![]() CH3OH(g)。
CH3OH(g)。
①完成该热化学方程式:CO(g)+ 2H2(g)![]() CH3OH(g)△H=______ kJ/mol;
CH3OH(g)△H=______ kJ/mol;
②某温度下,将2mol CO和6mol H2充入2L的密闭容器中,达到平衡,测得c(H2)= 2.2molL﹣1,则CO的转化率为______。
(2)T1℃时,此反应的平衡常数为K(T1)= 50。此温度下,在一个2L的密闭容器中加入一定量CO和H2,反应到某时刻测得各组分的浓度如下:
物质 | H2 | CO | CH3OH(g) |
浓度/(molL﹣1) | 0.2 | 0.2 | 0.4 |
①比较此时正、逆反应速率的大小:v正____v逆值(填“>”、“<”或“=”)。
②若其他条件不变,在T2℃反应l0min后又达到平衡,测得n(H2)= 0.3mol,试比较:温度T1___T2(填“>”、“=”或“<”,下同)T2℃时该反应的平衡常数K(T2)______50。
③若其他条件不变时,只改变反应的某一个条件,下列说法正确的是______。
a.若达到新平衡时c(CO)= 0.3mo1/L,平衡一定逆向移动
b.若将容器体积缩小到原来的一半,达到新平衡时,0.2mol/L<c(CO)<0.4mol/L
c.若向容器中同时加入0.4mol CO和0.8mol CH3OH(g),平衡不移动
d.若向容器中加入0.8mol CH3OH(g),达到新平衡时,CO的体积分数不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com