
����Ŀ��ʵ����̽��SO2��Fe(NO3)3��Һ��Ӧ��ԭ����װ������ͼ��ʵ����Yװ�ò�����ɫ����������˵������ȷ����
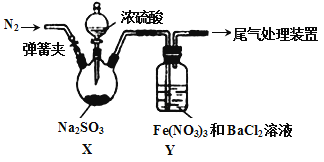
A. �μ�Ũ����֮ǰӦ���еIJ����Ǵ��ɼУ�ͨ��һ��ʱ��N2
B. Y�в����İ�ɫ������BaSO4��BaSO3
C. ������ɫ������ԭ�������������������SO2��NO3- ��Ӧ������SO42-
D. ����Fe(NO3)3����FeCl3��Y��Ҳ�ܲ�����ɫ������˵��Fe3+Ҳ�ܽ�SO2����

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)0.5mol CH4��������_____g���ڱ�״���µ����Ϊ______L������Լ______����ԭ�ӡ�
(2)����״����22.4L��HCl����ˮ���200mL����Һ��������Һ�����ʵ���Ũ��Ϊ______������300mL 0.5molL��1�Ȼ�����Һ����Ҫ1.5molL��1���Ȼ�����Һ�������______mL��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һþ�����Ͻ�������ϡ����ǡ����ȫ�ܽ⣬�ټ�������������Һ���������������ʵ������������Ƶ������ϵ��ͼ��ʾ����ԭ�Ͻ���þ�������ʵ���֮��Ϊ(���� )
A. 1��1B. 2��1C. 3��1D. 1��2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�����£�N2����)��H2����)����2mol NH3����)�ų�92.4 kJ���������мס��������ݻ���ͬ���ܱ��������ڳ����£������ܱ���������ͨ��1 molN2��3 mol H2���ﵽƽ��ʱ�ų�����Q1kJ�������ܱ���������ͨ��0.5 mol N2��1.5 mol H2���ﵽƽ��ʱ�ų�����Q2kJ�������й�ϵʽ��ȷ����
A.Q1=2Q2=92.4B.Ql��2Q2C.Q1��2Q2D.Q1=2Q2��92.4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��![]() �ڹ�ҵ��ũҵ�ȷ����й㷺��Ӧ�ã���ҵ�Ͽ��ɸ������̿���Ҫ�ɷ�Ϊ
�ڹ�ҵ��ũҵ�ȷ����й㷺��Ӧ�ã���ҵ�Ͽ��ɸ������̿���Ҫ�ɷ�Ϊ![]() ������
������![]() �����ʣ��Ʊ������ֹ����������£�
�����ʣ��Ʊ������ֹ����������£�
��ؽ������������������������![]() �������ʼ������
�������ʼ������![]() ������Ũ��Ϊ
������Ũ��Ϊ![]() ���㣩��
���㣩��
�������� |
|
|
|
|
|
��ʼ������pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 |
������ȫ��pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 |
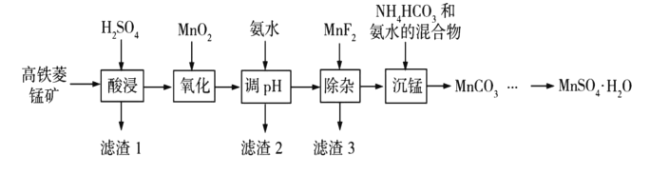
��1����������ʱ������Ӧ�����ӷ���ʽΪ___________��
��2������pH����Χ��5~6���õ�����2����Ҫ�ɷֳ�![]() ���___________��
���___________��
��3�������ӡ������м���![]() ��Ŀ����___________��
��Ŀ����___________��
��4�������̡������з�����Ӧ�Ļ�ѧ����ʽΪ___________��
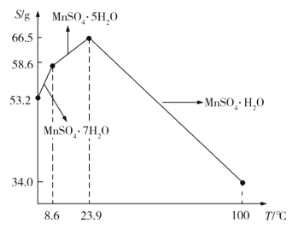
��5��![]() ��ˮ�е��ܽ�����¶ȵĹ�ϵ��ͼ��ʾ����
��ˮ�е��ܽ�����¶ȵĹ�ϵ��ͼ��ʾ����![]() ��ýϴ�����
��ýϴ�����![]() ����ķ����ǣ���
����ķ����ǣ���![]() ����������ϡ���ᣬ�����¶���80��~90��֮�������ᾧ��__________����������ƣ����õ�
����������ϡ���ᣬ�����¶���80��~90��֮�������ᾧ��__________����������ƣ����õ�![]() ���壬ϴ�ӡ���ɡ�����ͨ�����ü�ѹ��ɵ�ԭ����__________��
���壬ϴ�ӡ���ɡ�����ͨ�����ü�ѹ��ɵ�ԭ����__________��
��6����֪��![]() �������£�����Һ��
�������£�����Һ��![]() ����ʹ��Һ�е�
����ʹ��Һ�е�![]() �����������ҺpH��ΧΪ______________________��
�����������ҺpH��ΧΪ______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��amol FeS��bmol FeOͶ�뵽VL��c mol/L��������Һ�г�ַ�Ӧ����NO���壬���ó�����Һ�ɷֿɿ�����Fe(NO3)3��H2SO4�Ļ��Һ����Ӧ��δ����ԭ���������Ϊ
�� ��
����a+b����63g ����a+b����189g ����a+b��mol ��![]() mol
mol
A.�٢�B.�ڢ�C.�٢�D.�ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Դ��ȱ������������ٵ��ش����⣬�״���һ�ֿ�������Դ�����й㷺�Ŀ�����Ӧ��ǰ����
��1����֪��CO��H2��CH3OH��g����ȼ���ȷֱ�Ϊ283kJ/mol��285.8kJ/mol��768kJ/mol����ҵ��һ�����úϳ����������з�Ӧ�ϳɼ״���CO��g��+ 2H2��g��![]() CH3OH��g����
CH3OH��g����
����ɸ��Ȼ�ѧ����ʽ��CO��g��+ 2H2��g��![]() CH3OH��g����H=______ kJ/mol��
CH3OH��g����H=______ kJ/mol��
��ij�¶��£���2mol CO��6mol H2����2L���ܱ������У��ﵽƽ�⣬���c��H2��= 2.2molL��1����CO��ת����Ϊ______��
��2��T1��ʱ���˷�Ӧ��ƽ�ⳣ��ΪK��T1��= 50�����¶��£���һ��2L���ܱ������м���һ����CO��H2����Ӧ��ijʱ�̲�ø���ֵ�Ũ�����£�
���� | H2 | CO | CH3OH(g) |
Ũ��/��molL��1�� | 0.2 | 0.2 | 0.4 |
�ٱȽϴ�ʱ�����淴Ӧ���ʵĴ�С��v��____v��ֵ�����������������=������
���������������䣬��T2�淴Ӧl0min���ִﵽƽ�⣬���n��H2��= 0.3mol���ԱȽϣ��¶�T1___T2�����������=����������ͬ��T2��ʱ�÷�Ӧ��ƽ�ⳣ��K��T2��______50��
����������������ʱ��ֻ�ı䷴Ӧ��ijһ������������˵����ȷ����______��
a�����ﵽ��ƽ��ʱc��CO��= 0.3mo1/L��ƽ��һ�������ƶ�
b���������������С��ԭ����һ�룬�ﵽ��ƽ��ʱ��0.2mol/L��c��CO����0.4mol/L
c������������ͬʱ����0.4mol CO��0.8mol CH3OH��g����ƽ�ⲻ�ƶ�
d�����������м���0.8mol CH3OH��g�����ﵽ��ƽ��ʱ��CO�������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ָ����Ӧ�����ӷ���ʽ��ȷ����(����)
A.Fe��ϡ���ᷴӦ��2Fe��6H��=2Fe3����3H2��
B.��K2CO3��Һ��ͨ�����SO2��CO![]() ��2SO2��H2O=CO2��2HSO
��2SO2��H2O=CO2��2HSO![]()
C.��ǿ����Һ��NaClO��FeCl3��Ӧ����Na2FeO4��3ClO����2Fe3����5H2O=2 FeO![]() ��3Cl����10H��
��3Cl����10H��
D.�����Ƶ�Cu(OH)2������ȩ�е�ȩ����CH3CHO��Cu(OH)2��OH��![]() CH3COO����Cu��2H2O
CH3COO����Cu��2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��һ��ʵ��ij���廯ѧ���ʵ�ʵ��װ�ã�ͼ��BΪ���ء����ȴ�B����A��ͨ������������C�к�ɫ������ɫ�ޱ仯�����ر�Bʱ��C����ɫ������ɫ����Dƿ��ʢ�е���Һ��(����)

A. Ũ����B. �����Ȼ�����ҺC. Ũ����������ҺD. ������������Һ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com