
【题目】某铁的氧化物粉末可能含有FeO、Fe2O3中的一种或两种。某化学兴趣小组为验证该氧化物粉末的组成,做了如下实验:
(1)甲同学利用1mol/L的硫酸、KSCN溶液、酸性高锰酸钾溶液来确定其组成
编号 | 实验操作 | 实验现象与结论 |
① | 取少量粉末放入试管中,注入1mol/L的硫酸 | 粉末逐渐溶解,溶液呈黄绿色 |
② | 将①中所得溶液分成两份,向其中一份滴加几滴__________,振荡 | 若溶液________ ,说明有Fe2O3存在 |
③ | 向另一份溶液中加入少量__________,振荡 | 若溶液________ ,说明有FeO存在 |
(2)乙同学称取30.4g固体,按以下步骤进行实验:
步骤一 将固体置于烧杯中,加入1mol/L的硫酸将固体完全溶解
步骤二 往烧杯中先加入足量的氯水,充分反应后再加入足量的氢氧化钠溶液
步骤三 将步骤二所得的物质过滤洗涤后,灼烧至固体质量不再变化,得到32g红棕色固体
①步骤二中加入氯水的目的是__________________________________________;
②步骤三中沉淀洗涤的操作为__________________________________________;
③原固体中FeO和Fe2O3的物质的量之比为___________________。
【答案】KSCN溶液 变红 KMnO4溶液 紫色褪去 将Fe2+ 全部转化成Fe3+ 沿玻璃棒往漏斗中继续加蒸馏水至浸没沉淀,自然滤下,重复2-3次 2:1
【解析】
(1)②因Fe3+遇到KSCN溶液,溶液变为血红色;
③根据KMnO4溶液能氧化Fe2+,本身紫色褪去;
(2)根据实验要求解答,在计算原固体中FeO和Fe2O3的物质的量之比可根据题意列方程组。
(1)②Fe3+遇到KSCN溶液,溶液变为血红色,若溶液变为血红色,则“①”中溶液含有Fe3+,原固体中有Fe2O3,故本题答案为:KSCN溶液;变红;
③KMnO4溶液能氧化Fe2+,本身紫色褪去,若向另一份中加入少量KMnO4溶液,紫色褪去,则“①”中溶液含有Fe2+,原固体中有FeO,故本题答案为:KMnO4溶液;紫色褪去;
(2)①往烧杯中先加入足量的氯水,充分反应后再加入足量的氢氧化钠溶液,加入氯水的目的是因为溶液中含有Fe2+,先加入足量的氯水是为了将Fe2+ 全部转化成Fe3+,故本题答案为:将Fe2+ 全部转化成Fe3+;
②根据题知步骤三中沉淀洗涤的操作为:沿玻璃棒往漏斗中继续加蒸馏水至浸没沉淀,自然滤下,重复2-3次。故本题答案为:沿玻璃棒往漏斗中继续加蒸馏水至浸没沉淀,自然滤下,重复2-3次;
③根据题知步骤一发生的离子反应式为:FeO+2H+=Fe2++H2O,Fe2O3+6H+=2Fe3++3H2O;
步骤二发生的离子反应式为:2Fe2++Cl2=2Fe3++2Cl-;步骤三发生的化学反应式为:2Fe(OH)3 ![]() Fe2O3+3H2O
Fe2O3+3H2O
设FeO和Fe2O3的物质的量分别为x、y;则有72x+160y=30.4,再根据步骤三:灼烧至固体质量不再变化,得到32g红棕色固体,依据2Fe(OH)3 ![]() Fe2O3+3H2O 得出总的Fe3+的物质的量为0.4mol,最后根据铁元素守恒可得出x+2y=0.4,综上所述得出方程组:
Fe2O3+3H2O 得出总的Fe3+的物质的量为0.4mol,最后根据铁元素守恒可得出x+2y=0.4,综上所述得出方程组:![]() ,解得
,解得![]()
故原固体中FeO和Fe2O3的物质的量之比为:2:1


科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式中正确的是
A.碳酸氢铵溶液与足量的NaOH溶液混合后加热:NH4++OH-![]() NH3↑+H2O
NH3↑+H2O
B.Ca(HCO3)2溶液中滴加少量NaOH溶液 Ca2++HCO3-+OH-=CaCO3↓+H2O
C.NaHSO4溶液和Ba(OH)2溶液充分反应后溶液呈中性:Ba2++OH-+H++SO42-=BaSO4↓+H2O
D.向Fe(OH)2中加入稀硝酸:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将含amol金属钠和bmol金属铝的合金投入mg足量水中,完全溶解,无金属剩余,所得溶液密度为dgcm﹣3,下列相关计算式子中错误的是( )
A.NaOH的物质的量:(a﹣b)mol
B.NaAlO2的物质的量浓度:![]() mol/L
mol/L
C.标况下生成H2的体积:![]() L
L
D.参加反应的水的质量:18(a+1.5b)g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一镁、铝合金,用适量稀硫酸恰好完全溶解,再加入氢氧化钠溶液,析出沉淀的物质的量随氢氧化钠的体积关系如图所示,则原合金中镁、铝物质的量之比为( )
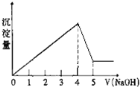
A. 1:1B. 2:1C. 3:1D. 1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】前四周期原子序数依次增大的元素A、B、C、D中,A和B的价电子层中未成对电子均只有1个,并且A-和B+的电子相差为8;与B位于同一周期的C和D,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2。回答下列问题:
(1)D2+的价层电子排布图为_____。
(2)四种元素中第一电离最小的是____,电负性最大的是____。(填元素符号)
(3)A、B和D三种元素组成的一个化合物的晶胞如图所示。
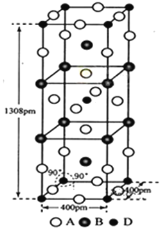
①该化合物的化学式为_____________;D的配位数为_______;
②列式计算该晶体的密度为___________g·cm-3。(列式并计算)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下,N2(气)和H2(气)生成2mol NH3(气)放出92.4 kJ热量。现有甲、乙两个容积相同的密闭容器,在常温下:①向密闭容器甲中通入1 molN2和3 mol H2,达到平衡时放出热量Q1kJ。②向密闭容器乙中通入0.5 mol N2和1.5 mol H2,达到平衡时放出热量Q2kJ。则下列关系式正确的是
A.Q1=2Q2=92.4B.Ql>2Q2C.Q1<2Q2D.Q1=2Q2≠92.4
查看答案和解析>>
科目:高中化学 来源: 题型:
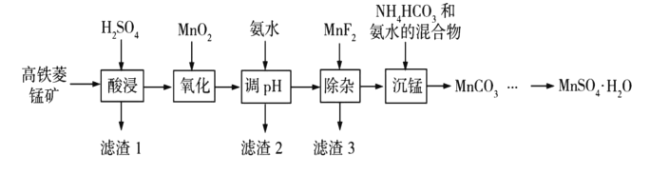
【题目】![]() 在工业、农业等方面有广泛的应用,工业上可由高铁菱锰矿(主要成分为
在工业、农业等方面有广泛的应用,工业上可由高铁菱锰矿(主要成分为![]() ,含有
,含有![]() 等杂质)制备,部分工艺流程如下:
等杂质)制备,部分工艺流程如下:
相关金属离子生成氢氧化物沉淀的![]() 如表(开始沉淀的
如表(开始沉淀的![]() 按离子浓度为
按离子浓度为![]() 计算):
计算):
金属离子 |
|
|
|
|
|
开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 |
沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 |
(1)“氧化”时发生反应的离子方程式为___________;
(2)“调pH”范围至5~6,得到滤渣2的主要成分除![]() 外还有___________;
外还有___________;
(3)“除杂”过程中加入![]() 的目的是___________;
的目的是___________;
(4)“沉锰”过程中发生反应的化学方程式为___________;
(5)![]() 在水中的溶解度与温度的关系如图所示。由
在水中的溶解度与温度的关系如图所示。由![]() 获得较纯净的
获得较纯净的![]() 晶体的方法是:将
晶体的方法是:将![]() 溶于适量的稀硫酸,控制温度在80℃~90℃之间蒸发结晶,__________(填操作名称),得到
溶于适量的稀硫酸,控制温度在80℃~90℃之间蒸发结晶,__________(填操作名称),得到![]() 晶体,洗涤、烘干。晶体通常采用减压烘干的原因是__________;
晶体,洗涤、烘干。晶体通常采用减压烘干的原因是__________;
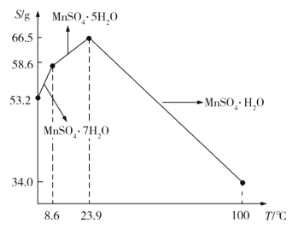
(6)已知:![]() 。室温下,若溶液中
。室温下,若溶液中![]() ,欲使溶液中的
,欲使溶液中的![]() ,则需调节溶液pH范围为______________________。
,则需调节溶液pH范围为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源短缺是人类社会面临的重大问题,甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)已知:CO、H2、CH3OH(g)的燃烧热分别为283kJ/mol、285.8kJ/mol、768kJ/mol。工业上一般利用合成气发生下列反应合成甲醇:CO(g)+ 2H2(g)![]() CH3OH(g)。
CH3OH(g)。
①完成该热化学方程式:CO(g)+ 2H2(g)![]() CH3OH(g)△H=______ kJ/mol;
CH3OH(g)△H=______ kJ/mol;
②某温度下,将2mol CO和6mol H2充入2L的密闭容器中,达到平衡,测得c(H2)= 2.2molL﹣1,则CO的转化率为______。
(2)T1℃时,此反应的平衡常数为K(T1)= 50。此温度下,在一个2L的密闭容器中加入一定量CO和H2,反应到某时刻测得各组分的浓度如下:
物质 | H2 | CO | CH3OH(g) |
浓度/(molL﹣1) | 0.2 | 0.2 | 0.4 |
①比较此时正、逆反应速率的大小:v正____v逆值(填“>”、“<”或“=”)。
②若其他条件不变,在T2℃反应l0min后又达到平衡,测得n(H2)= 0.3mol,试比较:温度T1___T2(填“>”、“=”或“<”,下同)T2℃时该反应的平衡常数K(T2)______50。
③若其他条件不变时,只改变反应的某一个条件,下列说法正确的是______。
a.若达到新平衡时c(CO)= 0.3mo1/L,平衡一定逆向移动
b.若将容器体积缩小到原来的一半,达到新平衡时,0.2mol/L<c(CO)<0.4mol/L
c.若向容器中同时加入0.4mol CO和0.8mol CH3OH(g),平衡不移动
d.若向容器中加入0.8mol CH3OH(g),达到新平衡时,CO的体积分数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对于实验装置的有关说法错误的是( )
A.装置Ⅰ:可以用来验证碳的非金属性比硅强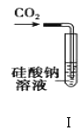
B.装置Ⅱ:可以用来比较Na2CO3和NaHCO3的热稳定性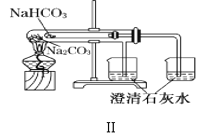
C.装置Ⅲ:先从①口进气收集满二氧化碳,再从②口进气,则可收集NO气体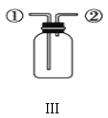
D.装置Ⅳ:可以用于制备Fe(OH)2并能保证相对较长时间观察到白色沉淀Fe(OH)2 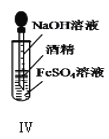
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com