
【题目】钛酸钡(BaTiO3)是电子陶瓷器件的重要基础原料。工业上以钛精矿(主要成分为TiO2)和BaCl2为主要原料制备钛酸钡粉体的工艺流程如下:

已知:①TiCl4水解生成H2TiO3沉淀;
②水溶液中含碳微粒随pH的分布如图所示。

(1) “氯化”在800 ℃时进行,其反应的化学方程式为________。
(2) “共沉淀”时,需控制溶液pH为10~11,其原因是:①___________;② ________。
(3) “滤液”中溶质的主要成分为________(填化学式)。过滤得到的固体通常用一定浓度的NH4HCO3溶液进行洗涤,其主要原因是___________。
(4) “煅烧”得到的钛酸钡粉体中钡钛质量比![]() ,钛酸钡粉体中可能含有的杂质为____________(填化学式)。
,钛酸钡粉体中可能含有的杂质为____________(填化学式)。
【答案】TiO2+2C+2Cl2![]() TiCl4+2CO pH>10,溶液中含碳微粒以CO32为主,可使Ba2+完全变成BaCO3沉淀 pH<11,可抑制H2TiO3沉淀溶解 NH4Cl 抑制或减少BaCO3的溶解 TiO2或H2TiO3或TiO2、H2TiO3
TiCl4+2CO pH>10,溶液中含碳微粒以CO32为主,可使Ba2+完全变成BaCO3沉淀 pH<11,可抑制H2TiO3沉淀溶解 NH4Cl 抑制或减少BaCO3的溶解 TiO2或H2TiO3或TiO2、H2TiO3
【解析】
钛精矿(主要成分为TiO2)和C、Cl2反应生成 TiCl4和CO,TiCl4加入氯化钡、碳酸氢铵、氨水控制pH,反应生成碳酸钡、H2TiO3沉淀和氯化铵溶液,过滤得到碳酸钡、H2TiO3沉淀,煅烧生成钛酸钡(BaTiO3)。
⑴根据题中信息“氯化”在800 ℃时进行,TiO2与C、Cl2反应生成 TiCl4和CO,其反应的化学方程式为TiO2+2C+2Cl2![]() TiCl4+2CO;故答案为:TiO2+2C+2Cl2
TiCl4+2CO;故答案为:TiO2+2C+2Cl2![]() TiCl4+2CO。
TiCl4+2CO。
⑵“共沉淀”时,说明生成碳酸钡、H2TiO3沉淀,因此需控制溶液pH为10~11,其原因是:反应要生成碳酸钡,尽量使得溶液碳微粒以碳酸根形式存在,钡离子和碳酸根结合生成碳酸钡沉淀;要形成H2TiO3沉淀,碱性不能太强,碱性太强会溶解H2TiO3沉淀;故答案为:pH>10,溶液中含碳微粒以CO32为主,可使Ba2+完全变成BaCO3沉淀;pH<11,可抑制H2TiO3沉淀溶解。
⑶根据前面分析得出“滤液”中溶质的主要成分为NH4Cl。为了减少或抑制碳酸钡沉淀洗涤时溶解一部分,因此过滤得到的固体通常用一定浓度的NH4HCO3溶液进行洗涤;故答案为:NH4Cl;抑制或减少BaCO3的溶解。
⑷钛酸钡(BaTiO3)中钡钛质量比![]() ,“煅烧”得到的钛酸钡粉体中钡钛质量比
,“煅烧”得到的钛酸钡粉体中钡钛质量比![]() ,说明钛酸钡粉体中可能含有的杂质为含钛的物质即TiO2或H2TiO3或TiO2、H2TiO3;故答案为:TiO2或H2TiO3或TiO2、H2TiO3。
,说明钛酸钡粉体中可能含有的杂质为含钛的物质即TiO2或H2TiO3或TiO2、H2TiO3;故答案为:TiO2或H2TiO3或TiO2、H2TiO3。


 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:高中化学 来源: 题型:
【题目】将含amol金属钠和bmol金属铝的合金投入mg足量水中,完全溶解,无金属剩余,所得溶液密度为dgcm﹣3,下列相关计算式子中错误的是( )
A.NaOH的物质的量:(a﹣b)mol
B.NaAlO2的物质的量浓度:![]() mol/L
mol/L
C.标况下生成H2的体积:![]() L
L
D.参加反应的水的质量:18(a+1.5b)g
查看答案和解析>>
科目:高中化学 来源: 题型:
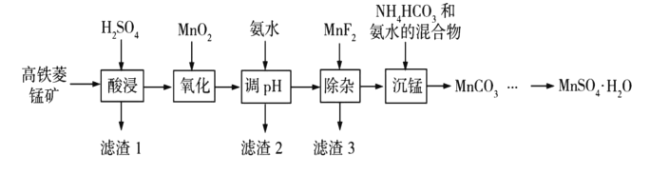
【题目】![]() 在工业、农业等方面有广泛的应用,工业上可由高铁菱锰矿(主要成分为
在工业、农业等方面有广泛的应用,工业上可由高铁菱锰矿(主要成分为![]() ,含有
,含有![]() 等杂质)制备,部分工艺流程如下:
等杂质)制备,部分工艺流程如下:
相关金属离子生成氢氧化物沉淀的![]() 如表(开始沉淀的
如表(开始沉淀的![]() 按离子浓度为
按离子浓度为![]() 计算):
计算):
金属离子 |
|
|
|
|
|
开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 |
沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 |
(1)“氧化”时发生反应的离子方程式为___________;
(2)“调pH”范围至5~6,得到滤渣2的主要成分除![]() 外还有___________;
外还有___________;
(3)“除杂”过程中加入![]() 的目的是___________;
的目的是___________;
(4)“沉锰”过程中发生反应的化学方程式为___________;
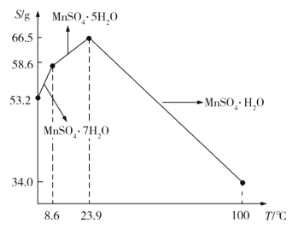
(5)![]() 在水中的溶解度与温度的关系如图所示。由
在水中的溶解度与温度的关系如图所示。由![]() 获得较纯净的
获得较纯净的![]() 晶体的方法是:将
晶体的方法是:将![]() 溶于适量的稀硫酸,控制温度在80℃~90℃之间蒸发结晶,__________(填操作名称),得到
溶于适量的稀硫酸,控制温度在80℃~90℃之间蒸发结晶,__________(填操作名称),得到![]() 晶体,洗涤、烘干。晶体通常采用减压烘干的原因是__________;
晶体,洗涤、烘干。晶体通常采用减压烘干的原因是__________;
(6)已知:![]() 。室温下,若溶液中
。室温下,若溶液中![]() ,欲使溶液中的
,欲使溶液中的![]() ,则需调节溶液pH范围为______________________。
,则需调节溶液pH范围为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源短缺是人类社会面临的重大问题,甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)已知:CO、H2、CH3OH(g)的燃烧热分别为283kJ/mol、285.8kJ/mol、768kJ/mol。工业上一般利用合成气发生下列反应合成甲醇:CO(g)+ 2H2(g)![]() CH3OH(g)。
CH3OH(g)。
①完成该热化学方程式:CO(g)+ 2H2(g)![]() CH3OH(g)△H=______ kJ/mol;
CH3OH(g)△H=______ kJ/mol;
②某温度下,将2mol CO和6mol H2充入2L的密闭容器中,达到平衡,测得c(H2)= 2.2molL﹣1,则CO的转化率为______。
(2)T1℃时,此反应的平衡常数为K(T1)= 50。此温度下,在一个2L的密闭容器中加入一定量CO和H2,反应到某时刻测得各组分的浓度如下:
物质 | H2 | CO | CH3OH(g) |
浓度/(molL﹣1) | 0.2 | 0.2 | 0.4 |
①比较此时正、逆反应速率的大小:v正____v逆值(填“>”、“<”或“=”)。
②若其他条件不变,在T2℃反应l0min后又达到平衡,测得n(H2)= 0.3mol,试比较:温度T1___T2(填“>”、“=”或“<”,下同)T2℃时该反应的平衡常数K(T2)______50。
③若其他条件不变时,只改变反应的某一个条件,下列说法正确的是______。
a.若达到新平衡时c(CO)= 0.3mo1/L,平衡一定逆向移动
b.若将容器体积缩小到原来的一半,达到新平衡时,0.2mol/L<c(CO)<0.4mol/L
c.若向容器中同时加入0.4mol CO和0.8mol CH3OH(g),平衡不移动
d.若向容器中加入0.8mol CH3OH(g),达到新平衡时,CO的体积分数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I。草酸(H2C2O4)与高锰酸钾在酸性条件下能够发生反应:
(实验1)甲同学用8.00 mL 0.001 mol/L KMnO4溶液与5.00 mL 0.01 mol/L H2C2O4溶液反应,研究不同条件对化学反应速率的影响。改变的条件如下:
组别 | KMnO4溶液 /mL | H2C2O4溶液 /mL | 10%硫酸体积/mL | 温度/℃ | 其他物质 |
Ⅰ | 8.00 | 5.00 | 3.00 | 20 | |
Ⅱ | 8.00 | 5.00 | 3.00 | 30 | |
Ⅲ | 8.00 | 5.00 | 1.00 | 20 | 2.00 mL蒸馏水 |
(1)写出草酸(H2C2O4)与高锰酸钾溶液在酸性条件下反应的离子方程式________。
(2)上述进行实验Ⅰ、Ⅲ的目的是探究__________对化学反应速率的影响。
(实验2)乙同学在研究草酸与高锰酸钾在酸性条件下反应的影响因素时发现,草酸与酸性高锰酸钾溶液开始一段时间反应速率较慢,溶液褪色不明显,但不久后突然褪色,反应速率明显加快。
(3)针对上述现象,乙同学认为草酸与高锰酸钾反应放热,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你猜想还可能是_______的影响。
(4)若用实验证明你的猜想,除了酸性高锰酸钾溶液和草酸溶液外,还需要选择的试剂最合理的是____(填字母)。
a.硫酸钾 b.水 c.二氧化锰 d.硫酸锰
Ⅱ.用如图所示的装置进行中和热的测定实验,分别取![]() 的
的![]() 溶液、
溶液、![]() 的硫酸进行实验,回答下列问题:
的硫酸进行实验,回答下列问题:
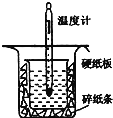
(1)从上图实验装置看,其中尚缺少的一种玻璃用品是__________,除此之外,装置中的一个明显错误是__________。
(2)近似认为![]() 的NaOH溶液和
的NaOH溶液和![]() 的硫酸溶液的密度都是
的硫酸溶液的密度都是![]() ,中和后生成溶液的比热容
,中和后生成溶液的比热容![]() ,通过以下数据计算中和热△H=__________(结果保留小数点后一位)。
,通过以下数据计算中和热△H=__________(结果保留小数点后一位)。
温度 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | ||
H2SO4 | NaOH | 平均值 | ||
1 | 26.2 | 26.0 | 26.1 | 29.5 |
2 | 27.0 | 27.4 | 27.2 | 32.3 |
3 | 25.9 | 25.9 | 25.9 | 29.2 |
4 | 26.4 | 26.2 | 26.3 | 29.8 |
(3)上述实验数值结果与![]() 有偏差,产生偏差的原因可能是(填字母)_____。
有偏差,产生偏差的原因可能是(填字母)_____。
a.实验装置保温、隔热效果差
b.用温度计测定![]() 溶液起始温度后直接测定H2SO4溶液的温度
溶液起始温度后直接测定H2SO4溶液的温度
c.分多次把![]() 溶液倒入盛有硫酸的小烧杯中
溶液倒入盛有硫酸的小烧杯中
d.将以上四实验测量温度均纳入计算平均值
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A.Fe与稀盐酸反应:2Fe+6H+=2Fe3++3H2↑
B.向K2CO3溶液中通入过量SO2:CO![]() +2SO2+H2O=CO2+2HSO
+2SO2+H2O=CO2+2HSO![]()
C.在强碱溶液中NaClO与FeCl3反应生成Na2FeO4:3ClO-+2Fe3++5H2O=2 FeO![]() +3Cl-+10H+
+3Cl-+10H+
D.用新制的Cu(OH)2检验乙醛中的醛基:CH3CHO+Cu(OH)2+OH-![]() CH3COO-+Cu+2H2O
CH3COO-+Cu+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将物质X逐渐加入Y溶液中,生成沉淀物质的量n2与所加X的物质的量n1的关系如图所示。符合图所示情况的是
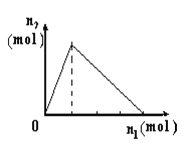
A | B | C | D | |
X | NaOH | AlCl3 | HCl | NaAlO2 |
Y | AlCl3 | NaOH | NaAlO2 | HCl |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对于实验装置的有关说法错误的是( )
A.装置Ⅰ:可以用来验证碳的非金属性比硅强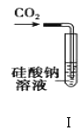
B.装置Ⅱ:可以用来比较Na2CO3和NaHCO3的热稳定性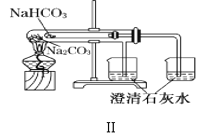
C.装置Ⅲ:先从①口进气收集满二氧化碳,再从②口进气,则可收集NO气体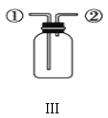
D.装置Ⅳ:可以用于制备Fe(OH)2并能保证相对较长时间观察到白色沉淀Fe(OH)2 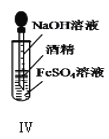
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示为800℃时A、B、C三种气体在密闭容器中反应时浓度的变化,只从图上分析不能得出的结论是( )

A.A是反应物
B.前2 min A的分解速率为0.1 mol·L-1·min-1
C.前2 min C的生成速率为0.2 mol·L-1·min-1
D.反应的方程式为:2A(g)![]() 2B(g)+C(g)
2B(g)+C(g)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com