
| A、导电导热性 | B、延展性 |
| C、有光泽 | D、熔点很高 |
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:
| A、(3a+b)mol | ||||
B、(
| ||||
C、(
| ||||
| D、(3a+b+2c)mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 有关信息 |
| A | 元素主要化合价为-2,原子半径为0.074n m |
| B | 所在主族序数与所在周期序数之差为4 |
| C | 原子半径为0.102n m,其单质在A的单质中燃烧,发出明亮的蓝紫色火焰 |
| D | 最高价氧化物的水化物,能按1:1电离出电子数相等的阴、阳离子 |
| E | 原子半径为0.075n m,最高价氧化物的水化物与其氢化物组成一种盐X |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
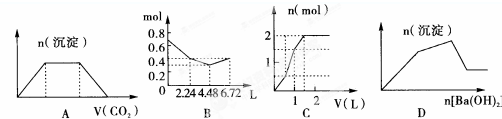
| A、将足量CO2通入含KOH和Ca(OH)2的混合液中,生成沉淀的物质的量(n)与通入CO2体积(y)的关系图A |
| B、往含0.2 molNaOH和0.1 mol Ca(OH)2的溶液中持续稳定地通人CO2气体,当气体为6.72 L(标态)时立即停止,则这一过程中,溶液中离子的物质的量和通入CO2气体的体积关系图B |
| C、向含1mol HCl和1mol MgSO4的混合溶液中加入1 mol?L-1Ba(OH)2溶液,产生沉淀的物质的量(n)与加入B(OH)2溶液积(V)间的关系图C |
| D、KAl(SO4)2液中逐滴加入Ba(OH)2溶液,产生沉淀的物质的量(n)与加入Ba(OH)2溶液体积(V)间的关系图D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Al2O3固体不导电且不溶于水,它在水溶液中不导,所以Al2O3不是电解质 |
| B、Na2SO4溶液导电,所以Na2SO4溶液是电解质 |
| C、CO2的水溶液可以导电,CO2是电解质 |
| D、1.5mol/L的NaCl溶液与1.0mol/L的MgCl2溶液相比较,导电能力后者强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 化学反应及其离子方程式 | 评价 |
| A | 在复盐NH4Fe(SO4)2溶液中逐滴加入Ba(OH)2溶液,可能发生的反应离子方程式是:Fe2++SO42-+Ba2++2OH-=BaSO4↓+Fe(OH)2↓ | 正确 |
| B | Fe3O4与稀硝酸反应:3Fe3O4+28H++NO3-=9Fe3++NO↑+14H2O | 错误,电子转移不守恒 |
| C | FeBr2溶液与等物质的量的Cl2反应:2Fe2++2Br-+2Cl2=2Fe3++4Cl-+Br2 | 错误,Fe2+与Br-的物质的量之比为1:2 |
| D | 4mol/LNaAlO2溶液和7mol/L盐酸等体积混合 4AlO2-+7H++H2O═3Al(OH)3↓+Al3+ | 正确 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com