
【题目】氮的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2。某同学在实验室中对NH3与NOx反应进行了探究。回答下列问题:
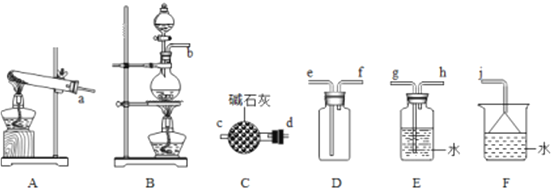
(1)氨气的制备
①用A装置可制备哪些常见气体_________,工业上制取氨气的化学方程式为____________。
②欲收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:发生装置→______(按气流方向,用小写字母表示)。
(2)氨气与二氧化氮的反应
将上述收集到的NH3充入注射器X中,向硬质玻璃管Y中加入少量催化剂并充入NO2(两端用夹子K1、K2夹好)。在一定温度下按图示装置进行实验。

操作步骤 | 实验现象 | 解释原因 |
打开K1,推动注射器活塞,使X中的气体缓慢通入Y管中 | ①Y管中_____________ | ②反应的化学方程式 ____________ |
将注射器活塞退回原处并固定,待装置恢复到室温 | Y管中有少量无色液珠 | 生成的气态水凝集 |
打开K2 | ③_______________ | ④______________ |
【答案】O2、NH3 N2+3H2 ![]() 2NH3d c f e i红棕色气体慢慢变浅8NH3+6NO2
2NH3d c f e i红棕色气体慢慢变浅8NH3+6NO2 ![]() 7N2 +12H2OZ中NaOH溶液产生倒吸现象反应后气体分子数减少,Y管中压强小于外压
7N2 +12H2OZ中NaOH溶液产生倒吸现象反应后气体分子数减少,Y管中压强小于外压
【解析】
(1)①根据装置图,A装置为加热固体制备气体的装置,可制备的气体有O2、NH3,工业上制取氨气的化学方程式为N2+3H2![]() 2NH3,故答案为:O2、NH3;N2+3H2
2NH3,故答案为:O2、NH3;N2+3H2![]() 2NH3;
2NH3;
②实验室用加热固体氯化铵和氢氧化钙的方法制备氨气,制备的气体中含有水蒸气,氨气为碱性气体,应选择盛有碱石灰干燥管干燥气体,氨气极易溶于水,密度小于空气密度所以应选择向下排空气法收集气体,氨气极易溶于水,尾气可以用水吸收,注意防止倒吸的发生,所以正确的连接顺序为:发生装置→d→c→f→e→i,故答案为:d→c→f→e→i;
(2)打开K1,推动注射器活塞,使X中的气体缓慢充入Y管中,则氨气与二氧化氮发生归中反应 生成无色氮气,所以看到现象为:红棕色气体慢慢变浅;根据反应8NH3+6NO2![]() 7N2+12H2O以及装置恢复至室温后气态水凝聚可判断反应后气体分子数减少,装置内压强降低,所以打开K2在大气压的作用下发生倒吸,故答案为:红棕色气体慢慢变浅;8NH3+6NO2
7N2+12H2O以及装置恢复至室温后气态水凝聚可判断反应后气体分子数减少,装置内压强降低,所以打开K2在大气压的作用下发生倒吸,故答案为:红棕色气体慢慢变浅;8NH3+6NO2 ![]() 7N2 +12H2O;Z中NaOH溶液产生倒吸现象;反应后气体分子数减少,Y管中压强小于外压。
7N2 +12H2O;Z中NaOH溶液产生倒吸现象;反应后气体分子数减少,Y管中压强小于外压。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 氢氟酸贮存在细口玻璃瓶里
B. 盛溴的试剂瓶里加一些水来防止溴挥发
C. 可用滴加酚酞看其是否变红的方法来检测久置的烧碱是否变质
D. 氯水保存在无色玻璃瓶中;液氯存贮存在钢瓶里
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向盛有少量过氧化钠固体的试管中滴加水,直到气体不再放出,加水稀释,取少量所得溶液,加入少量二氧化锰,又有气体放出,待气体不再放出后,再滴加酚酞,溶液变红。下列猜测不合理的是
A.过氧化钠和水反应生成氢氧化钠和氧气
B.过氧化钠和水反应的产物是过氧化氢和氧气
C.过氧化氢在二氧化锰催化作用下分解生成氧气和水
D.过氧化钠跟水反应生成氢氧化钠和过氧化氢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在无色透明的强酸性溶液中,能大量共存的离子组是
A.K+、Na+、NO3-、HCO3-B.K+,Cu2+、Na+、Cl-
C.Na+、Mg2+、NO3-、SO42-D.Ag+、Na+、Cl-、OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在无色透明的酸性溶液中,能大量共存的离子组是( )
A.Al3+、NH4+、Cl、HCO3B.Na+、NO3、SO42-、Fe2+
C.Na+、Mg2+、Cl、SO42-D.Fe3+、K+、Cl、NO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质存在如图所示的转化关系(部分产物已省略)。通常C为黄绿色气体单质,G为紫黑色固体单质。实验室中,常用固体E在B的催化下加热制取可助燃的气体单质H。请回答下列问题:
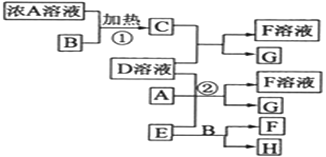
(1)分离G的水溶液中G的方法____________________________________________;
(2)反应①的化学方程式为_________;从该反应中获得干燥纯净的C气体的方法是______;
(3)反应②的离子方程式为_______________________________________________;
(4)写出另外一种实验室制取H的化学方程式_______________________________。
(5)C的水溶液可使有色布条褪色,写出其原因(用离子反应方程式表示)_____;
(6)C的水溶液具有漂白性,SO2也具有漂白性,二者混合_______(填“能、否)增加漂白效果,写出其原因(用化学方程式表示)_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在水溶液中1 mol Cl-、ClOx-(x=1,2,3,4)的能量(kJ)相对大小如图所示。下列有关说法正确的是

A. a、b、c、d、e中,c最稳定
B. b→a+c反应的活化能为反应物能量减生成物能量
C. b→a+d反应的热化学方程式为:3ClO-(aq)=ClO3-(aq)+2Cl-(aq)ΔH=+116 kJ·mol-1
D. 一定温度下,Cl2与NaOH溶液反应生成的产物有a、b、d,溶液中a、b、d的浓度之比可能为11∶1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关铁及其化合物的说法中正确的是( )
A.铁与水蒸气在高温下的反应产物为Fe2O3和H2
B.氢氧化亚铁是红褐色沉淀
C.Fe3+与KSCN溶液产生红色沉淀
D.除去FeCl2溶液中的FeCl3杂质可以向溶液中加入铁粉,然后过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如下:

(1)反应Ⅰ:2H2SO4(l)![]() 2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ·mol-1
2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ·mol-1
反应Ⅲ:S(s)+O2(g)![]() SO2(g) ΔH3=-297 kJ·mol-1
SO2(g) ΔH3=-297 kJ·mol-1
反应Ⅱ的热化学方程式:________________。
(2)对反应Ⅱ,在某一投料比时,两种压强下,H2SO4在平衡体系中物质的量分数随温度的变化关系如图所示。

p2_______p 1(填“>”或“<”),得出该结论的理由是________________。
(3)I-可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程如下。将ii补充完整。
i.SO2+4I-+4H+![]() S↓+2I2+2H2O
S↓+2I2+2H2O
ii.I2+2H2O+_________![]() _________+_______+2 I-
_________+_______+2 I-
(4)探究i、ii反应速率与SO2歧化反应速率的关系,实验如下:分别将18 mL SO2饱和溶液加入到2 mL下列试剂中,密闭放置观察现象。(已知:I2易溶解在KI溶液中)
序号 | A | B | C | D |
试剂组成 | 0.4 mol·L-1 KI | a mol·L-1 KI 0.2 mol·L-1 H2SO4 | 0.2 mol·L-1 H2SO4 | 0.2 mol·L-1 KI 0.0002 mol I2 |
实验现象 | 溶液变黄,一段时间后出现浑浊 | 溶液变黄,出现浑浊较A快 | 无明显现象 | 溶液由棕褐色很快褪色,变成黄色,出现浑浊较A快 |
①B是A的对比实验,则a=__________。
②比较A、B、C,可得出的结论是______________________。
③实验表明,SO2的歧化反应速率D>A,结合i、ii反应速率解释原因:________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com