
| 主族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑥ | ⑦ | ⑨ | |||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 4 | ② | ④ |
 ,故答案为:Ar;
,故答案为:Ar; ;
; ,故答案为:
,故答案为: ;
;

科目:高中化学 来源: 题型:
| A、澄清石灰水与过量的小苏打溶液反应:Ca2++OH-+HCO3-→CaCO3↓+H2O |
| B、向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O→2Al(OH)3↓+CO32- |
| C、向NaHSO4溶液中滴加Ba(OH)2至刚好沉淀完全:H++SO42-+Ba2++OH-→BaSO4↓+H2O |
| D、向含有0.1 mol溶质的FeI2溶液中通入0.1 mol的Cl2:2Fe+2I-+2Cl2→2Fe3++I2+4Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、C是三种短周期元素的单质,甲、乙是两种常见的化合物.这些单质和化合物之间存在如图所示关系.写出符合如图关系的A,B,C的化学式,(1)~(3)中的A不在同一主族.
A、B、C是三种短周期元素的单质,甲、乙是两种常见的化合物.这些单质和化合物之间存在如图所示关系.写出符合如图关系的A,B,C的化学式,(1)~(3)中的A不在同一主族.查看答案和解析>>
科目:高中化学 来源: 题型:
| 3 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、Cl-的结构示意图为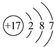 |
| B、D216O中,质量数之和是质子数之和的两倍 |
| C、在氮原子中,质子数为7而中子数不一定为7 |
| D、Be2+中的电子数和质子数之比一定为1:2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com