
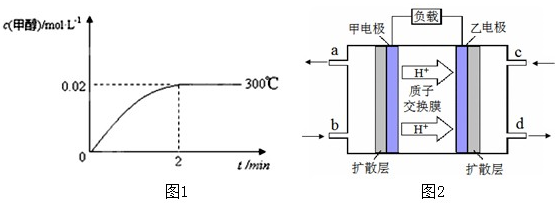
| 3 |
| 2 |
| ��c |
| ��t |
| 0.04mol/L |
| 2min |
| c(CH3OH) |
| c(CO)?c2(H2) |
| 0.02 |
| 0.08��0.252 |
| c(CH3OH) |
| c(CO)?c2(H2) |
| 0.50 |
| 0.25��0.502 |
 ��
�� ��CH3OH��l��+H2O��l��-6e-=CO2��g��+6H+��
��CH3OH��l��+H2O��l��-6e-=CO2��g��+6H+��


 ���¿쳵����������ϵ�д�
���¿쳵����������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
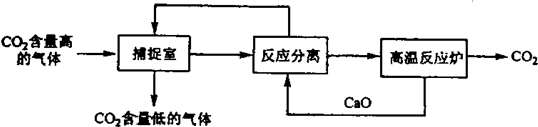
| A���ܺĴ��Ǹ÷�����һ��ȱ�� |
| B�����������У�����������ԭ��Ӧ���з�������ԭ��Ӧ |
| C������Ӧ���롱�����У�����Ļ��������ǹ��� |
| D�����������У���2�����ʿ���ѭ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ������� |
| ���� |
| �������� |
| ������ |
| NaOH��Һ |
| ���� |
| ϴ�� |
| ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ���� ���� |
��A | ��A | ��A | ��A | ��A | ��A | ��A | 0 |
| 2 | �� | �� | �� | |||||
| 3 | �� | �� | �� | �� | �� | |||
| 4 | �� | �� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| �� ���� |
��A | ��A | ��A | ��A | ��A | ��A | ��A | 0 |
| 2 | E | F | ||||||
| 3 | A | C | D | G | ||||
| 4 | B | H |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��c��SO42-����c��H+����c��NH4+����c��OH-�� |
| B��c��H+����c��SO42-����c��NH4+����c��OH-�� |
| C��c��OH-��-c��NH4+��=c��H+��-2c��SO42-�� |
| D��c��OH-��+c��NH3?H2O��=c��H+��-c��SO42-�� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com