
| A、澄清石灰水与过量的小苏打溶液反应:Ca2++OH-+HCO3-→CaCO3↓+H2O |
| B、向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O→2Al(OH)3↓+CO32- |
| C、向NaHSO4溶液中滴加Ba(OH)2至刚好沉淀完全:H++SO42-+Ba2++OH-→BaSO4↓+H2O |
| D、向含有0.1 mol溶质的FeI2溶液中通入0.1 mol的Cl2:2Fe+2I-+2Cl2→2Fe3++I2+4Cl- |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、Cu与Cl2燃烧反应 |
| B、Ba(OH)2?8H2O与NH4Cl反应 |
| C、灼热的炭与CO2反应 |
| D、氢氧化钠溶液与稀盐酸反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验目的 | 实验步骤及现象 | |||||||
| A | 检验亚硫酸钠试样是否变质 | 试样
| ||||||
| B | 证明酸性条件下H2O2氧化性比I2强 | 碘化钠溶液
| ||||||
| C | 证明Cl2的漂白性 | MnO2和稀盐酸
| ||||||
| D | 探究浓度对于化学平衡的影响 | FeCl3和KSCN混合溶液
|
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NH4++SO42-+Ba2++OH-→BaSO4↓+NH3?H2O |
| B、2Al3++3SO42-+3Ba2++6OH-→3BaSO4↓+2Al(OH)3↓ |
| C、Al3++2SO42-+2Ba2++4OH-→2BaSO4↓+AlO2-+2H2O |
| D、NH4++Al3++2SO42-+2Ba2++4OH-→2BaSO4↓+Al(OH)3↓+NH3?H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、③⑤ | B、①③⑥ |
| C、仅有⑤ | D、②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
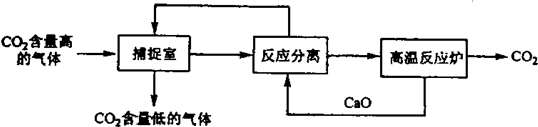
| A、能耗大是该方法的一大缺点 |
| B、整个过程中,既有氧化还原反应又有非氧化还原反应 |
| C、“反应分离”环节中,分离的基本操作是过滤 |
| D、整个过程中,有2种物质可以循环利用 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 主族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑥ | ⑦ | ⑨ | |||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 4 | ② | ④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com