
| A、NH4++SO42-+Ba2++OH-→BaSO4↓+NH3?H2O |
| B、2Al3++3SO42-+3Ba2++6OH-→3BaSO4↓+2Al(OH)3↓ |
| C、Al3++2SO42-+2Ba2++4OH-→2BaSO4↓+AlO2-+2H2O |
| D、NH4++Al3++2SO42-+2Ba2++4OH-→2BaSO4↓+Al(OH)3↓+NH3?H2O |


 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源: 题型:
| A、Fe2+、Cl-、SO42-、Na+ |
| B、NH4+、Al3+、NO3-、Cl- |
| C、Ca2+、K+、Cl-、HCO3- |
| D、K+、Na+、SO32-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
 的叙述正确的是( )
的叙述正确的是( )| A、通常情况下它们都是气态烷烃 |
| B、与所有烷烃互为同系物 |
| C、因为它们结构相似,所以它们的化学性质相似,物理性质相同 |
| D、均能用CnH2n+2组成通式来表示 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 镁燃料电池具有比能量高、安全方便、成本低等特点,常用的有镁-次氯酸盐燃料电池,镁-过氧化氢燃料电池等,图为镁-次氯酸盐燃料电池的工作原理图,下列说法不正确的是( )
镁燃料电池具有比能量高、安全方便、成本低等特点,常用的有镁-次氯酸盐燃料电池,镁-过氧化氢燃料电池等,图为镁-次氯酸盐燃料电池的工作原理图,下列说法不正确的是( )| A、电池的总反应式为Mg+ClO-+H2O═Mg(OH)2+Cl- |
| B、放电过程中OH-移向正极 |
| C、镁电池中镁均为负极,发生氧化反应 |
| D、镁-过氧化氢燃料电池,酸性电解质中正极反应式为H2O2+2H++2e-═2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、锌片为负极,且逐渐溶解 |
| B、铜片为正极,铜不易失电子而受到保护 |
| C、电子由锌片通过导线流向铜片,H+往铜片运动 |
| D、该装置能将电能转变为化学能 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、澄清石灰水与过量的小苏打溶液反应:Ca2++OH-+HCO3-→CaCO3↓+H2O |
| B、向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O→2Al(OH)3↓+CO32- |
| C、向NaHSO4溶液中滴加Ba(OH)2至刚好沉淀完全:H++SO42-+Ba2++OH-→BaSO4↓+H2O |
| D、向含有0.1 mol溶质的FeI2溶液中通入0.1 mol的Cl2:2Fe+2I-+2Cl2→2Fe3++I2+4Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
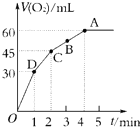 加入0.1mol MnO2粉末于50mL过氧化氢溶液(H2O2,ρ=1.1g?mL-1)中,在标准状况下放出气体的体积和时间的关系如图所示.
加入0.1mol MnO2粉末于50mL过氧化氢溶液(H2O2,ρ=1.1g?mL-1)中,在标准状况下放出气体的体积和时间的关系如图所示.| 3 |
| 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com