
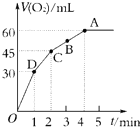
 加入0.1mol MnO2粉末于50mL过氧化氢溶液(H2O2,ρ=1.1g?mL-1)中,在标准状况下放出气体的体积和时间的关系如图所示.
加入0.1mol MnO2粉末于50mL过氧化氢溶液(H2O2,ρ=1.1g?mL-1)中,在标准状况下放出气体的体积和时间的关系如图所示.| 3 |
| 4 |
| ||
| 3 |
| 4 |
| ||
| 3 |
| 4 |


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.066 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A、氢化物的沸点为H2T<H2R |
| B、单质与稀盐酸反应的速率为L>Q |
| C、M与T形成的化合物具有两性 |
| D、L2+与R2-的核外电子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NH4++SO42-+Ba2++OH-→BaSO4↓+NH3?H2O |
| B、2Al3++3SO42-+3Ba2++6OH-→3BaSO4↓+2Al(OH)3↓ |
| C、Al3++2SO42-+2Ba2++4OH-→2BaSO4↓+AlO2-+2H2O |
| D、NH4++Al3++2SO42-+2Ba2++4OH-→2BaSO4↓+Al(OH)3↓+NH3?H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
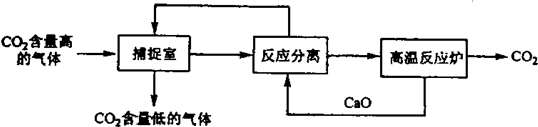
| A、能耗大是该方法的一大缺点 |
| B、整个过程中,既有氧化还原反应又有非氧化还原反应 |
| C、“反应分离”环节中,分离的基本操作是过滤 |
| D、整个过程中,有2种物质可以循环利用 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
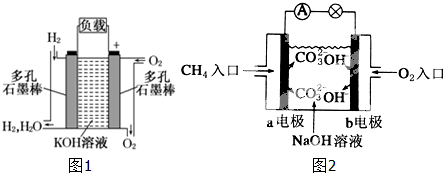
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com