
【题目】氮元素在海洋中的循环,是整个海洋生态系统的基础和关键。海洋中无机氮的循环过程可用下图表示。

(1)海洋中的氮循环起始于氮的固定,其中属于固氮作用的一步是_________(填图中数字序号)。
(2)下列关于海洋氮循环的说法正确的是__________(填字母序号)。
a. 海洋中存在游离态的氮
b. 海洋中的氮循环起始于氮的氧化
c. 海洋中的反硝化作用一定有氧气的参与
d. 向海洋排放含NO3-的废水会影响海洋中NH4+的含量
(3)有氧时,在硝化细菌作用下,NH4+可实现过程④的转化,将过程④的离子方程式补充完整:_____NH4+ + 5 O2==2 NO2- + ___ H+ + ______+ _______
(4)有人研究了温度对海洋硝化细菌去除氨氮效果的影响,下表为对10 L人工海水样本的监测数据:
温度/℃ | 样本氨氮含量/mg[ | 处理24 h[] | 处理48 h |
氨氮含量/mg | 氨氮含量/mg | ||
20 | 1008 | 838 | 788 |
25 | 1008 | 757 | 468 |
30 | 1008 | 798 | 600 |
40 | 1008 | 977 | 910 |
硝化细菌去除氨氮的最佳反应温度是______,在最佳反应温度时,48 h内去除氨氮反应的平均速率是______________mg·L-1·h-1。
(5)为了避免含氮废水对海洋氮循环系统的影响,需经处理后排放。图是电解产物氧化工业废水中氨氮(NH4+)的示意图。

①阳极的电极反应式:____________________;
②写出电解产物氧化去除氨氮的离子方程式:____________;
③若生成H2和N2的物质的量之比为3:1,则处理后废水的c(H+)将________(填“增大”、“不变”或“减小”)。
【答案】② ad 4 6 N2O 5H2O 25℃ 1.125 2Cl- -2e- = Cl2↑ 2NH4++3Cl2=N2+6Cl-+8H+ 增大
【解析】
(1)氮的固定作用是指游离态氮元素发生反应生成化合态氮元素的过程为固氮作用;
(2)结合转化关系图可知;
(3)由得失电子守恒、原子守恒、电荷守恒可写出正确的化学方程式;
(4)硝化细菌去除氨氮的最佳反应温度是处理24h和处理48h后氨氮含量最少。由单位mg·L-1·h-1列式计算可得;
(5)①和电源正极相连的为阳极,氯离子在阳极失电子生成氯气;
②氯气具有强氧化性酸性溶液中能氧化铵根离子为氮气除去;
③电子守恒得到6H+~3H2~6e-~N2~3Cl2~6e-~8H+,阳极产生的H+比阴极消耗的H+多,所以c(H+)将增大。
(1)氮的固定作用是指游离态氮元素发生反应生成化合态氮元素的过程为固氮作用,即单质变化为化合物,分析转化关系图可知只有反应②是氮气转化为铵根离子是固氮作用;
(2)a.氮气在水中的溶解度较小,海洋中存在少量游离态的氮,故a正确;
b.转化关系图可知,铵根离子中N的化合价为-3价,海洋中的氮循环起始于氮的还原,故b错误;
c.反硝化作用是指将硝酸盐转变成氮气的过程.硝化作用是指氨在微生物作用下氧化为硝酸的过程.硝化细菌将氨氧化为硝酸的过程。反硝化作用:反硝化细菌在缺氧条件下,还原硝酸盐,释放出分子态氮(N2)或一氧化二氮(N2O)的过程,不一定有氧参加,故c错误;
d.转化关系图中硝酸根离子增多,反硝化作用增强,向海洋排放含NO3-的废水会影响海洋中NH4+的含量,故d正确;
答案选ad;
(3)有氧时,在硝化细菌作用下,NH4+可实现过程④的转化,生成N2O、NO2-、H+和水,氮元素化合价-3价变化为+1价和+3价,氧元素化合价0价变化为-2价,电子转移总数20e-,所以配平得到离子方程式为:4NH4++5O2═2NO2-+6H++N2O+5H2O;
(4)硝化细菌去除氨氮的最佳反应温度是处理24h和处理48h后氨氮含量最少的温度是25°C,处理效果好,在最佳反应温度时,48h内去除氨氮反应的平均速率=![]() =1.125mg/(Lh);
=1.125mg/(Lh);
(5)①装置图分析可知和电源正极相连的为阳极,溶液中氯离子在阳极失电子生成氯气,电极反应为:2Cl--2e-=Cl2↑;
②氯气具有强氧化性酸性溶液中能氧化铵根离子为氮气除去,离子方程式为:2NH4++3Cl2=N2+6Cl-+8H+;
③电解池中阳极电极反应是:2Cl--2e-=Cl2↑, 3Cl2+2NH4+=N2+8H++6Cl-,阴极电极反应为:2H++2e-=H2↑,若生成n(H2):n(N2)=3:1,电子守恒得到6H+~3H2~6e-~N2~3Cl2~6e-~8H+,阳极产生的H+比阴极消耗的H+多,所以c(H+)将增大。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中可以作为2NO2(g) ![]() 2NO(g)+O2(g)达到平衡状态的标志是( )
2NO(g)+O2(g)达到平衡状态的标志是( )
①单位时间内生成n mol O2的同时生成2n mol NO2;②单位时间内生成n mol O2的同时生成2n mol NO;③混合气体的颜色不再改变;④混合气体的密度不再改变的状态;⑤混合气体的平均相对分子质量不再改变的状态;⑥混合气体中NO与O2的物质的量之比保持恒定;⑦混合气体中NO与NO2的物质的量之比保持恒定
A. ①③⑤⑦ B. ②④⑤ C. ①③④ D. ①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的分离或提纯过程中,不可能用到分液操作的是( )
A.分离植物油和水的混合物B.从溴水中提取溴单质
C.分离汽油和水的混合物D.将海水淡化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为实验室制取少量乙酸乙酯的装置图.下列关于该实验的叙述中,不正确的是
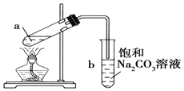
A. 向a试管中先加入浓硫酸,然后边摇动试管边慢慢加入乙醇,再加冰醋酸
B. 试管b中导气管下端管口不能浸入液面的原因是防止实验过程中发生倒吸现象
C. 实验时加热试管a的目的是及时将乙酸乙酯蒸出并加快反应速率
D. 采用长玻璃导管有导气兼冷凝的作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学降解NO3﹣的原理如图所示.
(1)电源A极为_____(填“正极”或“负极”),阴极反应式为_____。
(2)若电解过程中转移了1mol电子,则膜左侧电解液的质量减少量为_____g。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如图所示,其中盐桥为琼脂-饱和硝酸钾盐桥。请回答下列问题:

(1)电极X的材料是______;电解质溶液Y是_____;
(2)银电极为电池的______极,写出电极反应式:银电极________;X电极:________。
(3)外电路中的电子是从______电极流向______电极。
(4)盐桥中向CuSO4溶液中迁移的离子是______(填序号)。
A.K+ B.NO3- C.Ag+ D.SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次增大。四种元素形成的单质依次为m、n、p、q;这些元素组成的二元化合物r、t、u,其中u为形成酸雨的主要物质之一;25℃时,0.01mol/L的v溶液中pH=12。上述物质的转化关系如图所示。下列说法正确的是

A. 原子半径的大小:W>Z>Y>X
B. v能抑制水的电离而u能促进水的电离
C. 粘有q的试管可用酒精洗涤
D. Z分别与Y、W组成的化合物中化学健类型可能相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,浓度均为0.1molL-1的两种一元酸HX和HY溶液,用0.1molL-1的NaOH溶液分别进行滴定,滴定曲线如下图所示。下列有关叙述不正确的是


A. HX的酸性强于HY的酸性,且右图中m<1
B. 当![]() =1时,若两溶液同时升高温度,则c(Y-)/c(X-)减小
=1时,若两溶液同时升高温度,则c(Y-)/c(X-)减小
C. HY电离程度:b点大于a点
D. 当两溶液均呈中性时,c(X-)= c(Y-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯乙烷(C8H10)可生产塑料单体苯乙烯(C8H8),其反应原理是:C8H10(g)C8H8(g)+H2(g)△H=120kJ·mol-1某温度下,将0.40mol苯乙烷,充入2L真空密闭容器中发生反应,测定不同时间该容器内气体物质的量,得到数据如下表:
时间/min | 0 | 10 | 20 | 30 | 40 |
n(C8H10)/mol | 0.40 | 0.30 | 0.24 | n2 | n3 |
n(C8H8)/mol | 0.00 | 0.10 | n1 | 0.20 | 0.20 |
(1)当反应进行到20min时,该段时间内H2的平均反应速率是_____________。
(2)该温度下,该反应的化学平衡常数是_______________________。
(3)若保持其他条件不变,用0.40 molH2(g)和0.40molC8H8(g)合成C8H10(g),当有30kJ热量放出时,该反应中H2的转化率是__________。此时,该合成反应是否达到了平衡状态?_______(填“是”或“否”)。
(4)工业上以高温水蒸气作为反应体系的稀释剂(不参与反应),C8H10(g)的平衡转化率与水蒸气的用量、体系的温度、压强的关系如图Ⅰ、图Ⅱ所示。

①由图Ⅰ可知,T1________T2(填“大于”、“小于”或“等于”)。
②由图Ⅱ可知,当其他条件不变时,水蒸气的用量越大,C8H10的平衡转化率将________(填“越大”、“越小”或“不变”),原因是______________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com