
【题目】在不同条件下进行化学反应![]() ,B、D起始浓度均为0,反应物A的浓度
,B、D起始浓度均为0,反应物A的浓度![]() 随反应时间的变化情况如下表:下列说法不正确的是( )
随反应时间的变化情况如下表:下列说法不正确的是( )
序号 | 时间 温度 | 0 | 20 | 40 | 50 |
① | 800 |
|
|
|
|
② | 800 | x |
|
|
|
③ | 800 | y |
|
|
|
④ | 820 |
|
|
|
|
A.①中B在![]() min平均反应速率为
min平均反应速率为![]()
![]()
B.②中![]() ,可能使用了催化剂
,可能使用了催化剂
C.③中![]()
![]()
D.比较①④可知,该反应为吸热反应
科目:高中化学 来源: 题型:
【题目】两气体A、B分别为0.6mol、0.5mol。在0.4L密闭容器中发生反应:3A+B![]() mC+2D,经5min后达到平衡,此时C为0.2mol。又知在此反应时间D的平均反应速率 为0.1mol·L-1·min-1,以下结论正确的是( )
mC+2D,经5min后达到平衡,此时C为0.2mol。又知在此反应时间D的平均反应速率 为0.1mol·L-1·min-1,以下结论正确的是( )
A.m值为3B.B的转化率为20%
C.A的平均反应速率为0.1mol·L-1·min-1D.平衡时反应混合物总物质的量为1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)化合物N具有镇痛、消炎等药理作用,其合成路线如下:

(1)A的系统命名为____________,E中官能团的名称为____________。
(2)A→B的反应类型为____________,从反应所得液态有机混合物中提纯B的常用方法为____________。
(3)C→D的化学方程式为________________________。
(4)C的同分异构体W(不考虑手性异构)可发生银镜反应:且1 mol W最多与2 mol NaOH发生反应,产物之一可被氧化成二元醛。满足上述条件的W有____________种,若W的核磁共振氢谱具有四组峰,则其结构简式为____________。
(5)F与G的关系为(填序号)____________。
a.碳链异构 b.官能团异构 c.顺反异构 d.位置异构
(6)M的结构简式为____________。
(7)参照上述合成路线,以![]() 为原料,采用如下方法制备医药中间体
为原料,采用如下方法制备医药中间体![]() 。
。

该路线中试剂与条件1为____________,X的结构简式为____________;
试剂与条件2为____________,Y的结构简式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.已知25℃时,醋酸、碳酸、氢氰酸的电离平衡常数如下表:(单位省略)
醋酸 | 碳酸 | 氢氰酸 |
Ka=1.7×10 | Ka1=4.2×10 | Ka=6.2×10 |
(1)写出碳酸的第一步电离方程式__________________________________。
(2)25℃时,等浓度的三种溶液①NaCN 溶液、②Na2CO3溶液、③CH3COONa 溶液,pH由大到小的顺序为_____________________ (填序号)。
(3)25℃时,向NaCN溶液中通入少量CO2,反应的离子方程式为_______________。
(4)将浓度为0.02mol/L的HCN 与0.01mol/LNaOH 溶液等体积混合,测得混合溶液中c(Na+)>c(CN![]() ),下列关系正确的是_______。
),下列关系正确的是_______。
a.c(H+)>c(OH![]() ) b.c(H+)+c(HCN)=c(OH
) b.c(H+)+c(HCN)=c(OH![]() ) c.c(HCN)+c(CN
) c.c(HCN)+c(CN![]() )=0.01mol/L
)=0.01mol/L
II.请用有关电解质溶液的知识回答下列问题:
(1)某温度下纯水的c(H+)=4.0×10![]() mol/L,若温度不变,滴入稀盐酸,使c(H+)=2.0×10
mol/L,若温度不变,滴入稀盐酸,使c(H+)=2.0×10![]() mol/L,则此溶液中由水电离产生的c(H+)=_________。
mol/L,则此溶液中由水电离产生的c(H+)=_________。
(2)氢氧化铜悬浊液中存在如下平衡:Cu(OH)2(s) Cu2+(aq)+2OH-(aq),常温下其Ksp=c(Cu2+)·c2(OH-)=2×10![]() 。某硫酸铜溶液里c(Cu2+)=0.02 mol·L
。某硫酸铜溶液里c(Cu2+)=0.02 mol·L![]() ,如要生成Cu(OH)2沉淀,应调整溶液使之pH>________
,如要生成Cu(OH)2沉淀,应调整溶液使之pH>________
(3)向含有相同浓度Fe2+、Hg2+的溶液中滴加Na2S溶液,先生成______沉淀(填化学式)。在工业废水处理过程中,依据沉淀转化原理,可用FeS作为沉淀剂除去废水中的Hg2+,写出相应的离子方程式______________________。(Ksp(FeS)=6.3×10![]() ,Ksp(HgS)=6.4×10
,Ksp(HgS)=6.4×10![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在固定容积的密闭容器中,发生反应:2X(g)+Y(s)![]() Z(g)+W(g),其化学平衡常数K与温度T的关系如表:
Z(g)+W(g),其化学平衡常数K与温度T的关系如表:
T/℃ | 700 | 800 | 900 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.3 | 1.8 | 2.7 |
对该反应而言,下列说法正确的是
A.增大压强,平衡向正反应方向移动B.温度不变,增加X的用量,K增大
C.若K不变,则反应物的转化率一定不变D.该反应的正反应为吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对烟道气中![]() 进行回收再利用具有较高的社会价值和经济价值。
进行回收再利用具有较高的社会价值和经济价值。
I. ![]() 还原法
还原法

(1)一定条件下,由![]() 和
和![]() 反应生成
反应生成![]() 和
和![]() 的能量变化如图所示,每生成
的能量变化如图所示,每生成![]() ,该反应__________(填“放出”或“吸收”)的热量为____________。
,该反应__________(填“放出”或“吸收”)的热量为____________。
(2)在绝热恒容的密闭容器中,进行反应:![]() ,该反应的平衡常数表达式为_______________________,对此反应下列说法正确的是_________。
,该反应的平衡常数表达式为_______________________,对此反应下列说法正确的是_________。
a.若混合气体密度保持不变,则已达平衡状态
b.从反应开始到平衡,容器内气体的压强保持不变
c.达平衡后若再充入一定量![]() ,平衡常数保持不变
,平衡常数保持不变
d.分离出![]() ,正、逆反应速率均保持不变
,正、逆反应速率均保持不变
(3)向![]() 恒温恒容密闭容器中通入
恒温恒容密闭容器中通入![]()
![]() 和
和![]()
![]() ,分别进行
,分别进行![]() 三组实验。在不同条件下发生反应:
三组实验。在不同条件下发生反应:![]() ,反应体系总压强随时间的变化曲线如图所示,则三组实验温度的大小关系是
,反应体系总压强随时间的变化曲线如图所示,则三组实验温度的大小关系是![]() ______
______![]() ______
______![]() (填“
(填“![]() ”、“
”、“![]() ”或“
”或“![]() ”);实验
”);实验![]() 从反应开始至平衡时,反应速率
从反应开始至平衡时,反应速率![]() ______________。
______________。

II.![]() 溶液吸收法
溶液吸收法
常温下,用![]() 溶液吸收
溶液吸收![]() 的过程中,溶液
的过程中,溶液![]() 随吸收
随吸收![]() 物质的量的变化曲线如图所示。
物质的量的变化曲线如图所示。

(4)常温下,![]() 的二级电离平衡常数
的二级电离平衡常数![]() 的数值为_________________。
的数值为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为增强铝的耐腐蚀性,现以铅蓄电池为外电源(左池),以Al作阳极、Pb作阴极,电解稀硫酸(右池),使铝表面的氧化膜增厚。反应原理如下:
电池:Pb(s)+PbO2(s)+2H2SO4(aq)=2PbSO4(s)+2H2O(l);
电解池:2Al+3H2O ![]() Al2O3+3H2↑。
Al2O3+3H2↑。
关闭K,电解过程中,以下判断正确的是

A. 两池中H+均移向Pb电极
B. 左池每消耗3 mol Pb,右池生成2 mol Al2O3
C. 左池Pb电极质量增加,右池Pb电极质量不变
D. 左池正极反应:PbO2+4H++2e-=Pb2++2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】多巴胺的一种合成路线如下图所示

下列说法正确的是
A. 原料甲与苯酚互为同系物 B. 中间产物乙、丙和多巴胺都具有两性
C. 多巴胺不可能存在氨基酸类的同分异构体 D. 1mol 甲最多可以和2 mol Br2发生取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知AG=lg![]() ,电离度α=
,电离度α=![]() ×100%。常温下,向10mL0.1mol/LHX溶液中滴加0.1mol/LNaOH溶液,混合溶液中AG与滴加NaOH溶液体积的关系如图所示。
×100%。常温下,向10mL0.1mol/LHX溶液中滴加0.1mol/LNaOH溶液,混合溶液中AG与滴加NaOH溶液体积的关系如图所示。
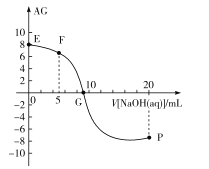
下列说法错误的是( )
A.F点溶液pH<7
B.G点溶液中c(Na+)=c(X-)>c(H+)=c(OH-)
C.V=10时,溶液中c(OH-)<c(HX)
D.常温下,HX的电离度约为1%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com