
【题目】反应:aA(g)+bB(g)![]() cC(g)(ΔH<0)在等容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如图所示:
cC(g)(ΔH<0)在等容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如图所示:
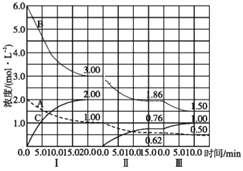
回答下列问题:
(1)反应的化学方程式中,a∶b∶c为___;
(2)B的平衡转化率αⅠ(B)、αⅡ(B)、αⅢ(B)中最小的是___;
(3)由第一次平衡到第二次平衡,平衡移动的方向是___,采取的措施是___。
【答案】1∶3∶2 αⅢ(B) 向正反应方向 从反应体系中移出产物C
【解析】
(1)根据图像中第Ⅰ阶段,平衡时A、B、C的浓度变化量,结合浓度变化量之比等于化学计量数之比计算;
(2)分别计算三个阶段B的转化率;
(3)第Ⅱ阶段中,C是从0开始的,瞬间A、B浓度不变,因此可以确定第一次平衡后,从体系中移出了C,据此分析解答。
(1)由图可知第Ⅰ阶段,平衡时△c(A)=2mol/L-1mol/L=1mol/L,△c(B)=6mol/L-3mol/L=3mol/L,△c(C)=2mol/L,浓度变化量之比等于化学计量数之比,故a∶b∶c=1mol/L∶3mol/L∶2mol/L=1∶3∶2,故答案为:1∶3∶2;
(2)B的平衡转化率αⅠ(B)=![]() ×100%=50%,αⅡ(B)=
×100%=50%,αⅡ(B)=![]() ×100%=38%,αⅢ(B)=
×100%=38%,αⅢ(B)=![]() ×100%=19.4%,B的平衡转化率αⅠ(B)、αⅡ(B)、αⅢ(B)中最小的是αⅢ(B),故答案为:αⅢ(B);
×100%=19.4%,B的平衡转化率αⅠ(B)、αⅡ(B)、αⅢ(B)中最小的是αⅢ(B),故答案为:αⅢ(B);
(3)第Ⅱ阶段C是从0开始的,瞬间A、B浓度不变,因此可以确定第一次平衡后从体系中移出了C,即减少了生成物浓度,平衡正向移动,故答案为:向正反应方向;从反应体系中移出产物C。


科目:高中化学 来源: 题型:
【题目】下图中A~L分别代表中学化学中的常见物质(部分反应的条件已略去)。A是一种常见氮肥,摩尔质量为79 g·mol-1。常温下,C是无色液体,E、L为常见金属单质,B、G、I、J、K为气体,其中D能使澄清的石灰水变浑浊,K呈红棕色。F为有磁性的黑色固体。
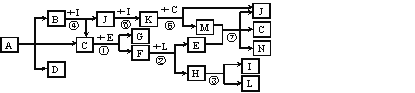
(1)A的化学式为____。
(2)写出反应④的化学方程式:____。
(3)写出反应①的化学方程式:____。
(4)若反应⑦中物质E过量,写出该反应的离子方程式:____。
(5)气体B或K直接排放到空气中会污染环境,在催化剂作用下两者会反应生成对环境无害的物质。写出该反应的方程式,并用单线桥表示电子转移的方向和数目:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T时,向2 L的密闭容器中充入一定量的A和B,发生反应:A(g)+B(g) ![]() C(s)+xD(g) ΔH>0,容器中A、B、D的物质的量随时间的变化如图所示。下列说法正确的是( )
C(s)+xD(g) ΔH>0,容器中A、B、D的物质的量随时间的变化如图所示。下列说法正确的是( )
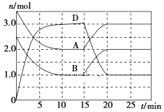
A.反应在前10 min内的平均反应速率v(D)=0.3mol·L-1·min-1
B.若平衡时保持温度不变,压缩容器体积,平衡向逆反应方向移动,平衡常数K值减小
C.反应至15min时,其他条件不变,改变的条件可能是缩小容器体积
D.反应至15min时,其他条件不变,改变的条件可能是降低反应体系温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】仅用下表提供的用品(夹持仪器和试剂任选)能实现相应实验目的的是( )
选项 | 实验目的 | 仪器 |
A | 从食盐水中获得NaCl晶体 | 坩埚、玻璃棒、酒精灯、泥三角 |
B | 除去氢氧化铝胶体中的泥沙 | 半透膜、烧杯、玻璃棒 |
C | 用0.1000mol/L盐酸测定未知浓度的NaOH溶液浓度 | 碱式滴定管、酸式滴定管、锥形瓶、胶头滴管、烧杯 |
D | 中和热的测定 | 烧杯、温度计、环形玻璃搅拌棒、泡沫塑料、硬纸板 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工业烟气中含有CO、CO2、N2、SO2等气体,用Na2SO3溶液吸收并回收SO2的过程如下图所示。
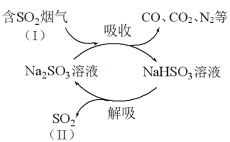
(1)SO2的浓度:I________II(填“>”或“<”)。
(2)在这个过程中可以循环使用的物质是________。
(3)上述吸收过程中主要反应的化学方程式是________。
(4)解吸过程需要加热,在这个过程中常伴有少量SO42-产生。
① 证明产物中含SO42-的实验方法是:取少量解吸产物的溶液,________(填操作和现象)。
② 产生SO42-的原因是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组要完成中和热的测定实验。
(1)实验桌上备有大、小两个烧杯、泡沫塑料、泡沫塑料板、胶头滴管、量筒、0.5 mol·L-1盐酸、0.55 mol·L-1氢氧化钠溶液,实验尚缺少的玻璃用品是___、___。
(2)他们记录的实验数据如下:
实验用品 | 溶液温度 | 中和热 | |||
t1 | t2 | ΔH | |||
a | 50mL 0.55mol·L-1NaOH溶液 | 50mL0.5mol·L-1HCl溶液 | 20℃ | 23.3℃ | ___ |
b | 50 mL0.55mol·L-1 NaOH溶液 | 50mL0.5mol·L-1 HCl溶液 | 20℃ | 23.5℃ | |
已知:反应后溶液的比热容c为4.18 kJ·℃-1·kg-1,各物质的密度均为1g·cm-3。计算完成表中ΔH=___。
(3)___(填“能”或“不能”)用Ba(OH)2溶液和硫酸代替氢氧化钠溶液和盐酸。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钛(Ti)因其硬度大、熔点高、常温时耐酸碱腐蚀而被广泛用作高新科技材料,被誉为“未来金属”。以钛铁矿(主要成分钛酸亚铁)为主要原料冶炼金属钛同时获得副产品甲的工业生产流程如下。请回答下列问题。
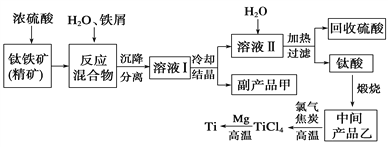
(1)钛酸亚铁(用R表示)与碳在高温下反应的化学方程式为2R+C═2Fe+2TiO2+CO2↑,钛酸亚铁的化学式为_______________;钛酸亚铁和浓H2SO4反应的产物之一是TiOSO4,反应中无气体生成,该反应的化学方程式为____________________。
(2)上述生产流程中加入铁屑的目的是_________________________,此时溶液Ⅰ中含有Fe2+、TiO2+和少量Mg2+等阳离子。常温下,其对应氢氧化物的Ksp如下表所示。
氢氧化物 | Fe(OH)2 | TiO(OH)2 | Mg(OH)2 |
Ksp | 8.0×10-16 | 1.0×10-29 | 1.8×10-11 |
①常温下,若所得溶液中Mg2+的物质的量浓度为0.0018mol/L,当溶液的pH等于_______时,Mg(OH)2开始沉淀。
②若将含有Fe2+、TiO2+和Mg2+的溶液加水稀释,立即析出大量白色沉淀,该反应的离子方程式为___________________________________________________________。
(3)中间产品乙与焦炭、氯气在高温下发生反应制取TiCl4的方程式为________。Mg还原TiCl4过程中必须在1070K的温度下进行,你认为还应该控制的反应条件是_________。除去所得金属钛中少量的金属镁可用的试剂是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方程式属于水解反应方程式的是( )
A.H2CO3![]() HCO3-+H+B.HCO3-+H2O
HCO3-+H+B.HCO3-+H2O![]() H3O++CO32-
H3O++CO32-
C.HCO3-+OH-=H2O+CO32-D.CO32-+H2O![]() HCO3-+OH-
HCO3-+OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列变化进行推断:
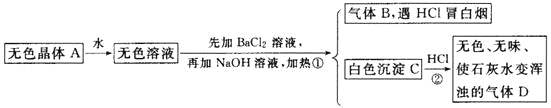
且已知对A加强热产生的气态物质的平均相对分子质量为26.3。
(1)推断A、B、C、D的化学式:A________,B________,C________,D________。
(2)写出①②变化的离子方程式:
①________________________________________________________________;
②________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com