
【题目】将10 mL 0.21 molL﹣1的盐酸和10 mL 0.1 molL﹣1Ba(OH)2溶液混合,再用水稀释至5 L,取出10 mL滴入甲基橙试剂,则溶液显示的颜色是( )
A. 蓝色B. 红色C. 黄色D. 橙色
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数。下列说法正确的是( )
A. 1mol月球背面的氦—3(3He)含有质子为2NA
B. 标况下,22.4L甲烷和1molCl2反应后的混合物中含有氯原子数小于2NA
C. 2molSO2与1molO2充分反应,转移的电子数为4NA
D. 25℃时,1L pH=13的Ba(OH)2溶液中含有OH-的数目为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)乙基叔丁基醚(以ETBE表示)是一种性能优良的高辛烷值汽油调和剂。用乙醇与异丁烯(以IB表示)在催化剂HZSM-5催化下合成ETBE,反应的化学方程式为:C2H5OH(g)+IB(g)=ETBE(g) △H。回答下列问题:
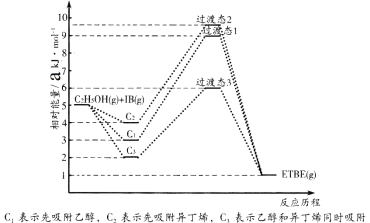
反应物被催化剂HZSM-5吸附的顺序与反应历程的关系如图所示,该反应的△H=__________ kJ·mol-1。反应历程的最优途径是________(填C1、C2或C3)。
(2)开发清洁能源是当今化工研究的一个热点问题。二甲醚(CH3OCH3)在未来可能替代柴油和液化气作为洁净液体燃料使用,工业上以CO和H2为原料生产CH3OCH3。工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应:
反应ⅰ:CO(g)+2H2(g)CH3OH(g) ΔH1=-99kJ·mol1
反应ⅱ:2CH3OH(g)CH3OCH3(g)+H2O(g) ΔH2=-23.5kJ·mol1
反应ⅲ:CO(g)+H2O(g)CO2(g)+H2(g) ΔH3=-41.2kJ·mol1
①在该条件下,若反应1的起始浓度分别为:c(CO)=0.6mol·L1,c(H2)=1.4mol·L1,8min后达到平衡,CO的转化率为50%,则8min内H2的平均反应速率为__________。
②在t℃时,反应2的平衡常数为400,此温度下,在1L的密闭容器中加入一定的甲醇,反应到某时刻测得各组分的物质的量浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
c(mol·L1) | 0.46 | 1.0 | 1.0 |
此时刻v正___v逆(填“>”“<”或“=”),平衡时c(CH3OCH3)的物质的量浓度是___。
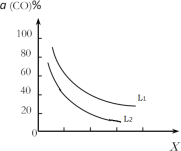
③催化反应室的总反应3CO(g)+3H2(g)CH3OCH3(g)+CO2(g),CO的平衡转化率α(CO)与温度、压强的关系如图所示,图中X代表___(填“温度”或“压强”),且L1___L2(填“>”“<”或“=”)。
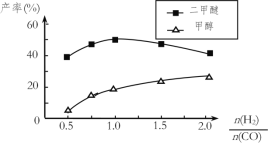
④在催化剂的作用下同时进行三个反应,发现随着起始投料比![]() 的改变,二甲醚和甲醇的产率(产物中的碳原子占起始CO中碳原子的百分率)呈现如图的变化趋势。试解释投料比大于1.0之后二甲醚产率和甲醇产率变化的原因:______________。
的改变,二甲醚和甲醇的产率(产物中的碳原子占起始CO中碳原子的百分率)呈现如图的变化趋势。试解释投料比大于1.0之后二甲醚产率和甲醇产率变化的原因:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某试液中只可能含有K+、NH4+、Fe2+、Al3+、Cl-、SO42-、CO32-、AlO2-中的若干种离子,离子浓度均为0.1mol·L-1,某同学进行了如下实验,下列说法正确的是

A. 无法确定原试液中是否含有Al3+、Cl-
B. 原溶液中存在NH4+、Fe2+、Cl-、SO42-
C. 无法确定沉淀C的成分
D. 滤液X中大量存在的阳离子有NH4+、Fe2+和Ba2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】BMO(Bi2MoO6)是种高效光催化剂,可用于光催化降解苯酚,原理如图所示。下列说法错误的是
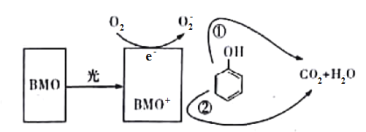
A.该过程的总反应为:C6H6O+ 7O2![]() 6CO2+3H2O
6CO2+3H2O
B.该过程中BMO+表现出较强的氧化性
C.①和②中被降解的苯酚的物质的量之比为1:3
D.光催化降解过程中,光能转化为化学能、热能等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁稀土合金广泛应用于航空、航天、电子、通讯和汽车制造业等领域。熔盐电解法是一种高效制备镁稀土合金的方法,实验室制取Mg-Gd合金(物质的量比为1:1)的电解槽示意图如下(相对原子质量Mg—24,Gd—157),下列说法正确的是

A.添加LiF、BaF2的作用是催化剂
B.阳极的电极反应式为2F——2e—= F2 ↑
C.当电路中通过0.1mol电子时,生成Mg- Gd合金的质量为3.62 g
D.电解结束后,铝、碳电极质量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。下列叙述正确的是 ( )

A.通电后中间隔室的SO42-向阳极迁移,阳极区溶液pH增大
B.该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C.阴极反应为4OH--4e-=O2↑+2H2O,阴极区溶液pH降低
D.当电路中通过1mol电子的电量时,会有11.2L O2生成(标况)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)有机物命名:
![]() ________________________________;
________________________________;
![]() ___________________________________;
___________________________________;
(2)依据名称写出物质:
3,4-二甲基-4-乙基庚烷 ______________;3,4,4-三甲基-1-戊炔 ______________。
(3)已知有机物降冰片二烯的分子结构可表示为: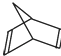
①降冰片二烯的分子式为 ______________;②降冰片二烯属于 __________;
a.环烃 b.不饱和烃 c.烷烃 d.烯烃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。下图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化。
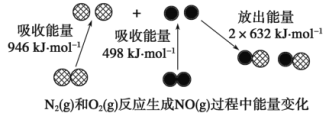
下列说法正确的是
A.1 mol N2(g)和1 mol O2(g)反应放出的能量为180 kJ
B.1molN2(g)和1molO2(g)具有的总能量小于2molNO(g)具有的总能量
C.通常情况下,N2(g)和O2(g)混合能直接生成NO
D.NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com