
【题目】实验室中模拟用甲烷与氯气反应得到的副产品来制取盐酸,原理如图:
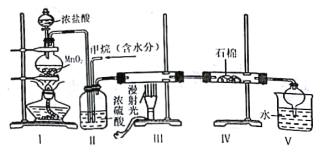
下列说法不正确的是
A.依据装管Ⅰ中的现象控制气流的速度
B.分离装置V中盐酸的最佳操作方法是分液
C.装置Ⅳ的石棉中可加入一些氢氧化钠粉末
D.实验过程中可观察到装置Ⅲ中硬质玻璃管内壁有附着的油珠
【答案】C
【解析】
实验室用浓盐酸和二氧化锰在加热条件下发生反应生成Cl2,Cl2经干燥后和甲烷在光照条件下发生取代反应,生成多种氯代烃和HCl,因氯代烃和甲烷均不溶于水,所以石棉的主要作用是除去未反应的氯气,装置Ⅴ对HCl进行吸收,同时可以防止倒吸。
A.浓硫酸可以干燥氯气和甲烷,同时根据冒出气泡的速率可以观察气体的流速,故A正确;
B.甲烷可以和氯气发生取代反应,产物为氯化氢和一氯甲烷、二氯甲烷、三氯甲烷和四氯化碳;所以E装置中除了有盐酸生成外,还含有二氯甲烷、三氯甲烷和四氯化碳,二氯甲烷、三氯甲烷和四氯化碳不溶于水,能分层,可用分液分开,故B正确;
C.装置Ⅳ的石棉主要作用是除去氯气,NaOH也会与HCl,应选用KI粉末等只与氯气反应的物质,故C错误;
D.氯气和甲烷的取代反应产物中除HCl和一氯甲烷外常温下均为油状液体,所以实验过程中可观察到装置Ⅲ中硬质玻璃管内壁有附着的油珠,故D正确;
故答案为C。


科目:高中化学 来源: 题型:
【题目】无水三氯化铬(CrCl3)为紫色晶体,在工业上主要用作媒染剂和催化剂,某化学小组用Cr2O3和CCl4在高温下制备无水三氯化铬,部分实验装置如图所示。
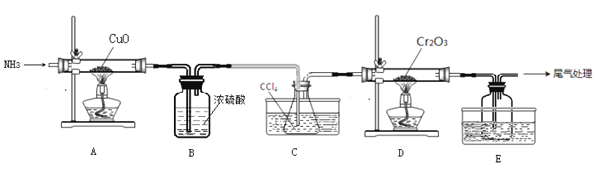
已知:①CrCl3熔点为83℃,易潮解,易升华,易溶于水但不易水解,高温下易被氧气氧化;②Cr2O3和CCl4在高温下反应的产物为CrCl3和光气(COCl2 )。请回答下列问题:
(1)装置A是氮气制备装置,氮气的作用是____________。
(2)装置B的作用为________。装置C和装置E的水槽中应分别盛有__________、____________。
(3)装置D中生成CrCl3和光气(COCl2 )的化学方程式为_________。
(4)该实验装置有设计不合理的地方,请写出改进方法:_________(写一点即可)
(5)产品中CrCl3质量分数的测定:
(i)称取0.3000 g得到的CrCl3样品溶于水并于250mL容量瓶中定容。
(ii)取25.00mL样品溶液于带塞的锥形瓶中,加热至沸腾后加入稍过量的Na2O2,稀释并加热煮沸,再加入过量的H2SO4酸化,将Cr3+氧化为Cr2O72-;再加入过量的KI固体,加塞摇匀,使铬完全以Cr3+形式存在
(iii)加入1mL指示剂,用0.0250 mol·L-1标准Na2S2O3溶液滴定至终点,平行测定三次,平均消耗标准Na2S2O3溶液21.00mL(已知2Na2S2O3+I2= Na2S4O6+2NaI)
①ii中加入稍过量的Na2O2后要加热煮沸,其主要原因是____________;加入KI发生反应的离子方程式为________________
②滴定实验可选用的指示剂为____________产品中CrCl3质量分数为_______%(结果保留两位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物F和K是重要的药物合成中间体,可通过以下路线合成:
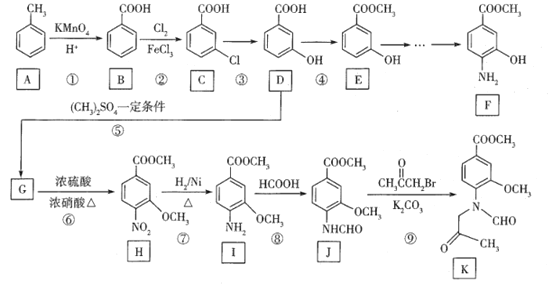
(1)C的化学名称为___________
(2)E中的官能团名称是__________。
(3)反应④所需的试剂和条件分别是___________、_____________。
(4)G的分子式为____________
(5)⑨的反应类型是_____________。
(6)写出符合下列条件的E的同分异构体的结构简式:_________(不考虑立体异构,只需写出3个)。
①能发生银镜反应;②遇FeCl3溶液发生显色反应;③核磁共振氢谱为五组峰,峰面积比为2:2:2:1:1
(7)设计由![]() 和HO(CH2)5OH制备
和HO(CH2)5OH制备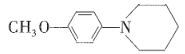 的合成路线:_______(无机试剂任选)。
的合成路线:_______(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向NaHCO3溶液中滴入盐酸,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是( )
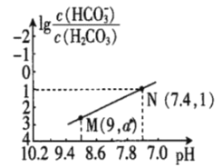
A.25℃时,H2CO3的一级电离K(H2CO3)=1.0×10-6.4
B.图中a=2.6
C.25℃时,HCO3-+H2O![]() H2CO3+OH-的Kh=1.0×10-7.6
H2CO3+OH-的Kh=1.0×10-7.6
D.M点溶液中:c(H+)+c(H2CO3)=c(Cl-)+2c(CO32-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛的化合物如TiO2、Ti(NO3)4、TiCl4、Ti(BH4)2等均有着广泛用途。
(1)写出Ti的基态原子的外围电子排布式_____。
(2)TiCl4熔点是﹣25℃,沸点136.4℃,可溶于苯或CCl4,该晶体属于_____晶体;BH4﹣中B原子的杂化类型为_____。
(3)在 TiO2催化作用下,可将CN﹣氧化成CNO﹣,进而得到N2。与CNO﹣互为等电子体的分子化学式为(只写一种)________。
(4)Ti3+可以形成两种不同的配合物:[Ti(H2O)6]Cl3(紫色),[TiCl(H2O)5]Cl2H2O(绿色)。绿色晶体中配体是_______。

(5)TiO2难溶于水和稀酸,但能溶于浓硫酸,析出含有钛酰离子的晶体,钛酰离子常成为链状聚合形式的阳离子,其结构形式如图1,化学式为______。
(6)金属钛内部原子的堆积方式是面心立方堆积方式,如图2。若该晶胞的密度为ρgcm﹣3,阿伏加德罗常数为NA,则该晶胞的边长为___cm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,碘在某液态有机物M和水之间的分配比D=85(分配比D=![]() ),向两个装有20mL 0.1mol/L I2的水溶液的锥形瓶中各加入20mL、40mL M,充分振荡后静置。下列说法正确是
),向两个装有20mL 0.1mol/L I2的水溶液的锥形瓶中各加入20mL、40mL M,充分振荡后静置。下列说法正确是
A.锥形瓶中水层为无色,M层为紫色,
B.20mL中M层的I2浓度约为0.099mol/L
C.I2单质溶于有机物M时需要断裂化学键
D.40mL中M层的I2浓度大于20mL中M层的I2浓度.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氨(NOCl)是有机合成中的重要试剂,为黄色气体或红褐色液体(熔点-64.5℃,沸点-5.5℃),具有刺鼻恶臭味,遇水和潮气水解,有多种方法制备。
(1)将5g经300℃下干燥了3h并研细的KCl粉末装 50mL带有接头及抽真空用活塞的玻璃容器内。将容器尽量减压,在减压下通入0.002molNO2。反应12~36min即可完成,NO2红棕色消失,出现黄色亚硝酰氯,同时还得到一种盐,该盐的化学式为_____________,氯化钾需要“干燥”的原因是_____________________________。
(2)实验室可由氯气与一氧化氮在常温常压下合成亚硝酰氯,装置如图所示:
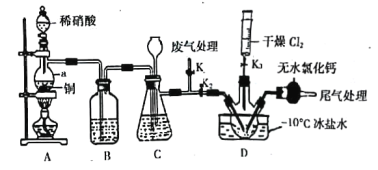
①仪器a的名称为____________________________;
②B装置的作用是____________________________;
③实验开始时,先打开K1,关闭K2、K3,再打开分液漏斗活塞滴入适量稀硝酸,当观察到装置C中________________时,打开K3向装置D三颈瓶中推入干燥纯净的Cl2,当瓶中充满黄绿色气体时,再关闭K1、K3,打开K2制备NOCl。
(3)测定产品纯度:取(2)中w g D中液态产品溶于蒸馏水,配制成250 mL溶液;用酸式滴定管准确量取25.00 mL所配制溶液于锥形瓶中,滴加几滴K2CrO4溶液作指示剂,用滴定管盛装c mol·L-1 AgNO3标准溶液滴定至终点,消耗标准溶液体积为V mL。(已知:Ag2CrO4为砖红色固体,忽略杂质参与反应)
①盛装AgNO3标准溶液的滴定管是_____________(填“酸式”或“碱式”)棕色滴定管;判断达到滴定终点的方法是_____________。
②该产品纯度为_____________(用代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国化工专家侯德榜的“侯氏制碱法”为世界制碱工业做出了突出的贡献,如图所示是某厂应用“侯氏制碱法”生产纯碱的工艺流程图,据图回答:
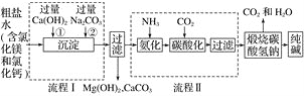
(1)上述流程图中,可循环利用的物质是____________。
(2)流程Ⅰ后过滤所得滤液中含有的溶质有__________。
(3)流程Ⅱ先通入氨气,再通入二氧化碳,如果反过来,二氧化碳的吸收率会降低,这是因为___________。
(4)用一个化学反应方程式表示出流程Ⅱ中发生的总反应____。
(5)工业生产纯碱的流程中,碳酸化时溶液中先析出碳酸氢钠而没有析出氯化铵的原因是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(I)某温度时,在2 L的容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示。请通过计算回答下列问题。
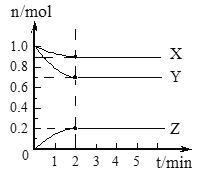
(1)列式计算反应开始至2 min,Y的平均反应速率___________。
(2)分析有关数据,写出X、Y、Z的反应方程式___________。
(3)由图中看出:________分钟后,A、B、C各物质的物质的量不再随时间而变化,说明在这个条件下,该反应已达到了________________状态。
(II)将纯锌片和纯铜片按如图所示方式插入100 mL相同浓度的稀硫酸中一段时间,回答下列问题:
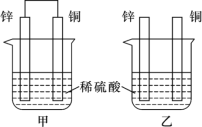
①下列说法正确的是____________(填字母代号)。
A.甲、乙均为化学能转变为电能的装置
B.乙中铜片上没有明显变化
C.甲中铜片质量减少、乙中锌片质量减少
D.两烧杯中溶液的pH均增大
②在相同时间内,两烧杯中产生气泡的速度:甲____乙(填“>”、“<“或“=”)。
③请写出图中构成原电池的装置正极的电极反应式______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com