
����Ŀ��(I)ij�¶�ʱ����2 L�������У�X��Y��Z������������ʵ�����ʱ��ı仯������ͼ��ʾ����ͨ������ش��������⡣
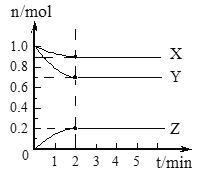
(1)��ʽ���㷴Ӧ��ʼ��2 min��Y��ƽ����Ӧ����___________��
(2)�����й����ݣ�д��X��Y��Z�ķ�Ӧ����ʽ___________��
(3)��ͼ�п�����________���Ӻ�A��B��C�����ʵ����ʵ���������ʱ����仯��˵������������£��÷�Ӧ�Ѵﵽ��________________״̬��
(II)����пƬ�ʹ�ͭƬ����ͼ��ʾ��ʽ����100 mL��ͬŨ�ȵ�ϡ������һ��ʱ�䣬�ش��������⣺
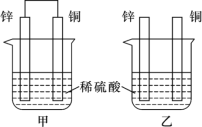
������˵����ȷ����____________(����ĸ����)��
A���ס��Ҿ�Ϊ��ѧ��ת��Ϊ���ܵ�װ��
B������ͭƬ��û�����Ա仯
C������ͭƬ�������١�����пƬ��������
D�����ձ�����Һ��pH������
������ͬʱ���ڣ����ձ��в������ݵ��ٶȣ���____��(������������������������)��
����д��ͼ�й���ԭ��ص�װ�������ĵ缫��Ӧʽ______________________��
���𰸡�0.075 mol(L min)-1 v (X): v (Y): v (Z) =��n(X):��n(Y):��n(Z)=0.1mol:0.3mol:0.2mol=1:3:2
��Ӧ����ʽ�ǣ�X(g)+3Y(g)2Z(g) 2 �������µĻ�ѧƽ��(��ѧ��Ӧ��) BD �� 2H+ +2e��= H2��
��������
(I)(1)����ƽ����Ӧ����=![]() ���㣻(2)����ͼ֪����Ӧ����X��Y����������Z��ͬһ���淴Ӧ��ͬһ��ʱ���ڣ������ʵ����ʵ����仯��֮�ȵ����������֮�ȣ�(3)��Ӧ�ﵽƽ��״̬ʱ�������ʵ����ʵ������䡣
���㣻(2)����ͼ֪����Ӧ����X��Y����������Z��ͬһ���淴Ӧ��ͬһ��ʱ���ڣ������ʵ����ʵ����仯��֮�ȵ����������֮�ȣ�(3)��Ӧ�ﵽƽ��״̬ʱ�������ʵ����ʵ������䡣
(II)�ף�ԭ����нϻ��õ�п��������Zn -2e��= Zn2+��ͭ��������2H+ +2e��= H2����ͭ�缫�ϲ������ݣ����У������γ�ԭ��أ���п������ֱ�ӷ�Ӧ����пƬ�ϲ������ݡ�
(I)(1)��Ӧ��ʼ��2min��Y��ƽ����Ӧ����=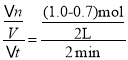 mol(L min)-1=0.075mol(L min)-1���ʴ�Ϊ��0.075mol(L min)-1��
mol(L min)-1=0.075mol(L min)-1���ʴ�Ϊ��0.075mol(L min)-1��
(2)����ͼ֪����Ӧ����X��Y����������Z���ﵽƽ��ʱ��n��X��=��1.0-0.9��mol=0.1mol����n��Y��=��1.0-0.7��mol=0.3mol����n��Z��=��0.2-0��mol=0.2mol��ͬһ���淴Ӧ��ͬһ��ʱ���ڣ������ʵ����ʵ����仯��֮�ȵ����������֮�ȣ���X��Y��Z�ļ�����֮��=0.1mol��0.3mol��0.2mol=1��3��2�����Ը÷�Ӧ����ʽΪX(g)+3Y(g)2Z(g)���ʴ�Ϊ��X(g)+3Y(g)2Z(g)��
(3)��ͼ�п�����2���Ӻ�A��B��C�����ʵ����ʵ���������ʱ����仯��˵������������£��÷�Ӧ�Ѵﵽ�˸������µĻ�ѧƽ��(��ѧ��Ӧ��)״̬���ʴ�Ϊ��2���������µĻ�ѧƽ��(��ѧ��Ӧ��)��
(II)��A����Ϊ��ѧ��ת��Ϊ���ܵ�װ�ã����в��γɵ�������A����
B������ͭƬ��û�����Ա仯��пƬ�ܽ⣬����пƬ�ϲ������ݣ���B��ȷ��
C������пƬ�������٣�ͭƬ�������䣻����пƬ�������٣�ͭƬ����Ҳ���䣬��C����
D�����ձ��о�����Zn��2H��=Zn2����H2����H��Ũ�ȼ�С����Һ��pH������D��ȷ��
�ʴ�Ϊ��BD��
�ڼ����γ�ԭ��أ��ӿ췴Ӧ���ʣ�����ͬʱ���ڣ����ձ��в������ݵ��ٶȣ��ף��ҡ��ʴ�Ϊ������
�������������ӵõ������������������ĵ缫��Ӧʽ2H+ +2e��= H2�����ʴ�Ϊ��2H+ +2e��= H2����


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������ģ���ü�����������Ӧ�õ��ĸ���Ʒ����ȡ���ᣬԭ����ͼ��
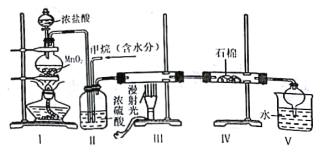
����˵������ȷ����
A.����װ�ܢ��е���������������ٶ�
B.����װ��V���������Ѳ��������Ƿ�Һ
C.װ�â���ʯ���пɼ���һЩ�������Ʒ�ĩ
D.ʵ������пɹ۲쵽װ�â���Ӳ�ʲ������ڱ��и��ŵ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ұ�𡢺˹�ҵ��ũҵ�����²��ϵȷ��涼����Ҫ��Ӧ�ã�һ��������þ����ȡ���еĹ������̣�

��֪:��þ�����Ҫ�ɷ�ΪMg2B2O5��H2O����ɰ�Ļ�ѧʽΪNa2B4O7)��10H2O��
�ش��������⣺
(1)��þ��Ҫ���鴦������Ŀ����_______��NaOHŨ��Һ����þ��Ӧ�Ļ�ѧ����ʽΪ__________________________________(���������ʲ��뷴Ӧ)��
(2)ʵ���ҹ��˲�����Ҫ�õ��IJ������������ձ���_______��______��ϴ�ӳ����IJ�������Ϊ_____________________________________��
(3)�Խ���������������ˮMgCl2����HCl��Χ�н��е�ԭ��___________________��
(4)��֪H3BO3ΪһԪ���ᣬ����NaOH��Ӧ�Ļ�ѧ����ʽΪNaOH+H3BO3=Na[B(OH)4]��д��H3BO3�ĵ��뷽��ʽ��_________________________________________��
(5)ʵ����һ��������H3BO3�ڲ�ͬ�¶��·ֽ��������ͼ��ʾ��ͼ��A��B��C��D���Ӧ�õ������ʶ�Ϊ�����
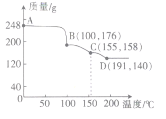
��C��Ӧ�����ʿɱ�ʾΪ2B2O3��nH2O����n=_______
��д��C��D�����з�����Ӧ�Ļ�ѧ����ʽ��______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾΪ����ϸ���IJ���Ԫ�ؼ����������a��b��c��d����С�������ʣ�X��Y��Z������������ʣ�C��H��O��N��P������ѧԪ�أ���������ش��������⡣
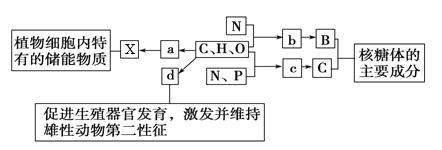
��1������a��________����������a�ij����Լ���_____���ڶ���ϸ���ڣ�������X�������Ƶ�������______��������X���Ԫ����ͬ���ڶ��ֲ��ϸ���о��ɺ��е�������Ĵ���������______��
��2������b��________����ij��Y���Ӻ���2��ֱ����������18��b���ӣ�ƽ����Է�������Ϊ128����ɣ����Y���ӵ���Է���������ԼΪ______��
��3������c������ϸ���й���________�֣�������________�IJ�ͬ������c�����ͬ��
��4������d��________��d��________��ά����d�����ڹ̴������ʡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ȤС�������ͼ��ʾ��װ�ý���ԭ���ԭ����̽�������������������

A.a��b������ʱ��пƬ�����������ɣ���װ�ò����γ�ԭ���
B.a��b�õ�������ʱпƬΪ�����������ķ�ӦʽΪ��Zn-2e-=Zn2+
C.a��b�õ�������ʱ��������Zn����������Cu���پ�ϡ��������Zn
D.����a��b�Ƿ����ӣ�ϡ��������뷴Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��N2O����Ϊ��Ц������Ҳ��һ���������塣�����ѧ֪ʶ���ش��������⣺
(1)п�뼫ϡ���ᷴӦ������N2O���÷�Ӧ�Ļ�ѧ����ʽΪ___________������������������������뷴Ӧ����������ʵ���֮��Ϊ___________��
(2)��֪�������ʵ�����������£�
���� | N2O(g) | CO(g) | N2(g) | CO2(g) |
�������/kJmol-1 | 475.5 | 283.0 | 393.5 | 0 |
��N2O(g)��CO(g)��Ӧ����N2(g)��CO2(g)���Ȼ�ѧ����ʽΪ____________��
���������������䣬�����Ч�������÷�Ӧ���ʱ佫_______(����������������С������������)��
(3)�������ܴ�N2O�ķֽ⣬��Ӧ����(����)���£�
i.I2(g)2I(g)
ii.I(g)��N2O(g)��N2(g)��IO(g)
iii.2IO(g)��2N2O(g)��2N2(g)��2O2(g)��I2(g)
ʵ��������ڷ�Ӧ����c(I)ʼ�մ���c(IO)���ɴ��Ʋ⣬��Ӧ����ii_________iii(����>������<����������)��
(4)һ���¶��£�������ܱ������г���2 mol N2O(g)��3 mol NO(g)��������Ӧ��N2O(g)��NO(g)N2(g)��NO2(g) ��H�����N2����������¶ȡ�ʱ��Ĺ�ϵ��ͼ��ʾ��
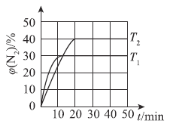
�١�H___________0(����>������<����������)��
��������������÷�Ӧ�ﵽƽ��״̬����___________(����ĸ)��
A.���������ܶȲ��ٸı� B.��Է����������ٸı�
C.NO��NO2������������� D.N2O������������ٸı�
��T1ʱ���÷�Ӧ��ƽ�ⳣ��K��___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����淴ӦA��g��+3B��g��2C��g�� ��H=��Q kJ/mol���мס��������ݻ���ͬ�Ҳ�����ܱ���������������м���1molA��3molB����һ�������´ﵽƽ��ʱ�ų�����ΪQ1 kJ������ͬ�������£����������м���2mol C�ﵽƽ�����������ΪQ2kJ����֪Q1=4Q2��������������ȷ���ǣ�������
A. ����C��ת����Ϊ20%
B. Q1+Q2=Q
C. �ﵽƽ����������м���0.2 molA��0.6molB��1.6molC��ƽ��������Ӧ�����ƶ�
D. ���е��Ȼ�ѧ��Ӧ����ʽΪ2C��g��A��g��+3B��g�� ��H=+4Q2kJmol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ����������Ӧ���۾���ȷ����
ѡ�� | ���� | ���� | ���� |
A | �����½�AlƬ����Ũ������ | �����Ա仯 | Al��Ũ�����Ӧ |
B | ��ij��Һ����μ������� | ������ɫ��ζ���� | ����Һ�к��� |
C | ��ij��Һ�еμ�ϡNaOH��Һ����ʪ��ĺ�ɫʯ����ֽ�����Թܿ� | ��ֽ������ | ԭ��Һ���� |
D | ����ij��Һ����μ����Ȼ�����Һ���ټ�ϡ���� | �а�ɫ�����������ҳ������ܽ� | ����Һ��һ������ |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ȼҵ��ԭ��ʾ��ͼ��ͼ������˵����ȷ����
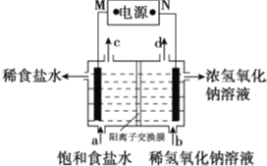
A. M����
B. ͨ��ʹ�Ȼ��Ʒ�������
C. ����c�ռ���������������
D. ͨ��һ��ʱ���������pH����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com