
【题目】硼在冶金、核工业、农业、高新材料等方面都有重要的应用,一种利用硼镁矿制取粗研的工艺流程:

已知:硼镁矿的主要成分为Mg2B2O5·H2O,硼砂的化学式为Na2B4O7)·10H2O。
回答下列问题:
(1)硼镁矿要粉碎处理,其目的是_______,NaOH浓溶液与硼镁矿反应的化学方程式为__________________________________(不考虑杂质参与反应)。
(2)实验室过滤操作中要用到的玻璃仪器包括烧杯、_______、______。洗涤沉淀的操作方法为_____________________________________。
(3)试解释流程中生成无水MgCl2需在HCl氛围中进行的原因:___________________。
(4)已知H3BO3为一元弱酸,其与NaOH反应的化学方程式为NaOH+H3BO3=Na[B(OH)4],写出H3BO3的电离方程式:_________________________________________。
(5)实验测得一定质量的H3BO3在不同温度下分解的曲线如图所示。图中A、B、C、D点对应得到的物质都为纯净物。
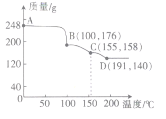
①C对应的物质可表示为2B2O3·nH2O,则n=_______
②写出C到D过程中发生反应的化学方程式:______________。
【答案】增大固体与溶液的接触面积,增大反应速率 Mg2B2O5H2O+2NaOH=2Mg(OH)2 +2NaBO2 漏斗 玻璃棒 向漏斗中加入蒸馏水至浸没沉淀,待水自然流下,重复操作2~3次 抑制MgCl2水解或防止生成Mg(OH)2 H3BO3+ H2O![]() [B(OH)4]-+H+ 1 H2B4O7
[B(OH)4]-+H+ 1 H2B4O7![]() 2B2O3+H2O
2B2O3+H2O
【解析】
硼镁矿主要成分为Mg2B2O5H2O,硼砂的化学式为Na2B4O710H2O;硼镁矿加入氢氧化钠浓溶液,待完全溶解后再过滤得到滤渣氢氧化镁,滤渣中加入浓盐酸溶解,通过蒸发浓缩得到氯化镁结晶水合物,在氯化氢气流中加热得到氯化镁固体,电解得到镁;滤液中主要是NaBO2,浓缩后通入适量二氧化碳气体得到硼砂,溶于热水后调pH至2~3制取H3BO3,冷却结晶得到H3BO3晶体,加热得到B2O3,Mg和B2O3混合在高温下生成MgO和B。
(1)硼镁矿的主要成分为Mg2B2O5H2O,难溶于水,所以预先进行粉碎处理以增大固体与溶液的接触面积,增大反应速率;根据后续对滤渣的处理可知滤渣为Mg(OH)2,B元素变为2NaBO2,结合元素守恒可得化学方程式为Mg2B2O5H2O+2NaOH=2Mg(OH)2 +2NaBO2;
(2)过滤用到的玻璃仪器有漏斗、烧杯、玻璃棒;洗涤沉淀是为了除去其表面的杂质,洗涤操作为向漏斗中加入蒸馏水至浸没沉淀,待水自然流下,重复操作2~3次;
(3)MgCl2中Mg2+会水解生成Mg(OH)2,若直接加热MgCl2·7HO,则会促进水解,不能得到无水MgCl2 ,所以要在HCl氛围中加热,抑制MgCl2水解,得到无水MgCl2;
(4)由于H3BO3为一元弱酸,其与NaOH反应的化学方程式为NaOH+ H3BO3=Na[B(OH)4],说明其酸根离子为[B(OH)4]-,H3BO3本身不能电离出H+,但在水中易结合一个OH-生成[B(OH)4]-,同时生成H+,从而体现弱酸性,所以其电离方程式为H3BO3+ H2O![]() [B(OH)4]-+H+;
[B(OH)4]-+H+;
(5)①依据图中数据,起始时有248gH3BO3,物质的量为4 mol,第一次分解得到产物176 g,失水72 g(即4 mol),因此B点对应的物质为HBO2 (物质的量为4 mol),第二次分解得到产物158g,再失水1 mol,依据原子守恒,C点得到的物质的化学式为H2B4O7,故可表示为2B2O3·H2O,即n=1;
②第三次分解再失水1mol,所以第三次失水后的产物为B2O3,故C到D的化学方程式为H2B4O7![]() 2B2O3+H2O。
2B2O3+H2O。


科目:高中化学 来源: 题型:
【题目】有机化合物F和K是重要的药物合成中间体,可通过以下路线合成:
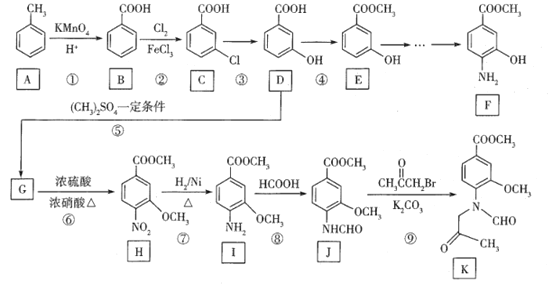
(1)C的化学名称为___________
(2)E中的官能团名称是__________。
(3)反应④所需的试剂和条件分别是___________、_____________。
(4)G的分子式为____________
(5)⑨的反应类型是_____________。
(6)写出符合下列条件的E的同分异构体的结构简式:_________(不考虑立体异构,只需写出3个)。
①能发生银镜反应;②遇FeCl3溶液发生显色反应;③核磁共振氢谱为五组峰,峰面积比为2:2:2:1:1
(7)设计由![]() 和HO(CH2)5OH制备
和HO(CH2)5OH制备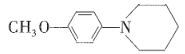 的合成路线:_______(无机试剂任选)。
的合成路线:_______(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氨(NOCl)是有机合成中的重要试剂,为黄色气体或红褐色液体(熔点-64.5℃,沸点-5.5℃),具有刺鼻恶臭味,遇水和潮气水解,有多种方法制备。
(1)将5g经300℃下干燥了3h并研细的KCl粉末装 50mL带有接头及抽真空用活塞的玻璃容器内。将容器尽量减压,在减压下通入0.002molNO2。反应12~36min即可完成,NO2红棕色消失,出现黄色亚硝酰氯,同时还得到一种盐,该盐的化学式为_____________,氯化钾需要“干燥”的原因是_____________________________。
(2)实验室可由氯气与一氧化氮在常温常压下合成亚硝酰氯,装置如图所示:
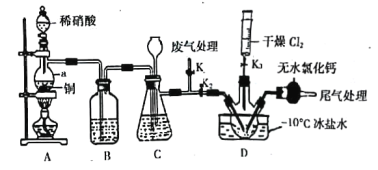
①仪器a的名称为____________________________;
②B装置的作用是____________________________;
③实验开始时,先打开K1,关闭K2、K3,再打开分液漏斗活塞滴入适量稀硝酸,当观察到装置C中________________时,打开K3向装置D三颈瓶中推入干燥纯净的Cl2,当瓶中充满黄绿色气体时,再关闭K1、K3,打开K2制备NOCl。
(3)测定产品纯度:取(2)中w g D中液态产品溶于蒸馏水,配制成250 mL溶液;用酸式滴定管准确量取25.00 mL所配制溶液于锥形瓶中,滴加几滴K2CrO4溶液作指示剂,用滴定管盛装c mol·L-1 AgNO3标准溶液滴定至终点,消耗标准溶液体积为V mL。(已知:Ag2CrO4为砖红色固体,忽略杂质参与反应)
①盛装AgNO3标准溶液的滴定管是_____________(填“酸式”或“碱式”)棕色滴定管;判断达到滴定终点的方法是_____________。
②该产品纯度为_____________(用代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国化工专家侯德榜的“侯氏制碱法”为世界制碱工业做出了突出的贡献,如图所示是某厂应用“侯氏制碱法”生产纯碱的工艺流程图,据图回答:
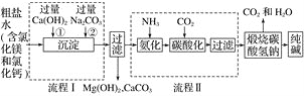
(1)上述流程图中,可循环利用的物质是____________。
(2)流程Ⅰ后过滤所得滤液中含有的溶质有__________。
(3)流程Ⅱ先通入氨气,再通入二氧化碳,如果反过来,二氧化碳的吸收率会降低,这是因为___________。
(4)用一个化学反应方程式表示出流程Ⅱ中发生的总反应____。
(5)工业生产纯碱的流程中,碳酸化时溶液中先析出碳酸氢钠而没有析出氯化铵的原因是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酰苯胺是一种白色有光泽片状结晶或白色结晶粉末,是磺胺类药物的原料, 可用作止痛剂、退热剂、防腐剂和染料中间体,乙酰苯胺的制备原理为:![]() +CH3COOH
+CH3COOH![]() +H2O,有关物质的性质如下表:
+H2O,有关物质的性质如下表:
名称 | 式量 | 性状 | 密度/g·cm-3 | 沸点/℃ | 溶解度 | |
苯胺 | 93 | 无色油状液体,易氧化 | 1.02 | 184.4 | 微溶于水 | 易溶于乙醇、乙醚 |
乙酸 | 60 | 无色液体 | 1.05 | 118.1 | 易溶于水 | 易溶于乙醇、乙醚 |
乙酰苯胺 | 135 | 白色晶体 | 1.22 | 304 | 微溶于冷水,溶于热水 | 易溶于乙醇、乙醚 |
注:刺形分馏柱的作用相当于二次蒸馏,用于沸点差别不太大的混合物的分离。
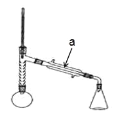
实验步骤:
步骤 1:在圆底烧瓶中加入无水苯胺 9.2 mL,冰醋酸 17.4 mL,锌粉 0.1 g,安装仪器, 加入沸石,调节加热温度,使分馏柱顶温度控制在 105℃ 左右,反应约 60~80 min,反应 生成的水及少量醋酸被蒸出。
步骤 2:在搅拌下,趁热将烧瓶中的物料以细流状倒入盛 100 mL 冰水的烧杯中,剧烈搅拌,并冷却,结晶,抽滤、洗涤、干燥,得到乙酰苯胺粗品。
步 骤 3:将此粗乙酰苯胺进行重结晶,晾干,称重,计算产率。
(1)仪器 a 的名称____________________;
(2)步骤 1 加热可用______________(填“水浴”或“油浴”);
(3)制备过程中加入粒的作用:___________________;
(4)从化学平衡的角度分析,控制分馏柱上端的温度在 105℃左右的原因_______________________;
(5)乙酰苯胺粗品因含杂质而显色,欲用重结晶进行提纯,步骤如下:粗产品溶于沸水中配 成饱和溶液→再加入少量蒸馏水→加入活性炭脱色→加热煮沸→趁热过滤→________________→过 滤→洗涤→干燥;
(6)该实验最终得到纯品 10.8g,则乙酰苯胺的产率是______________;
(7)如果重结晶过程中,加入活性炭过多,会造成产率下降,其可能原因为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~I分别表示中学化学中常见的一种物质,它们之间相互关系如下图所示(部分反应物、生成物没有列出)。已知H为固态氧化物,F是红褐色难溶于水的沉淀,且A、B、C、D、E、F六种物质中均含同一种元素。
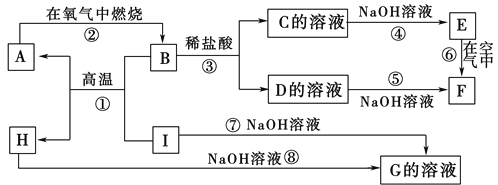
请填写下列空白:
(1)A、B、C、D、E、F六种物质中所含的同一种元素的名称是________。
(2)反应①的化学方程式为_____________________________________
反应③的离子方程式为________________________
反应⑧的化学方程式为_____________________________________
(3)反应⑥过程中的现象是______________________________。
(4)1molI发生反应后生成的A高温下与足量的水蒸气反应,生成的气体换算成标准状况下占______L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对有关事实分析不正确的是
选项 | 事实描述 | 相关知识分析 |
A | 谚语“正月打雷麦谷堆”、“雷雨肥庄稼” | 自然固氮:N2+2O2 |
B | 成语“滴水石穿” | 包含CaCO3+CO2+H2O=Ca(HCO3)2 |
C | 《木草经集注》记载“强烧之,紫青烟起,云是真硝石也。” | “硝石”为KNO3,钾元素的焰色反应为紫色 |
D | 野外之鬼磷,其火色青,其状如炬,或聚或散,俗称鬼火,实乃诸血之磷光也。 | “磷光”是指磷化氢(PH3)自燃,将化学能转化为光能 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(I)某温度时,在2 L的容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示。请通过计算回答下列问题。
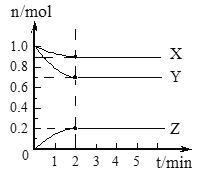
(1)列式计算反应开始至2 min,Y的平均反应速率___________。
(2)分析有关数据,写出X、Y、Z的反应方程式___________。
(3)由图中看出:________分钟后,A、B、C各物质的物质的量不再随时间而变化,说明在这个条件下,该反应已达到了________________状态。
(II)将纯锌片和纯铜片按如图所示方式插入100 mL相同浓度的稀硫酸中一段时间,回答下列问题:
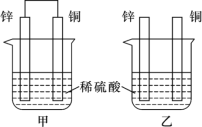
①下列说法正确的是____________(填字母代号)。
A.甲、乙均为化学能转变为电能的装置
B.乙中铜片上没有明显变化
C.甲中铜片质量减少、乙中锌片质量减少
D.两烧杯中溶液的pH均增大
②在相同时间内,两烧杯中产生气泡的速度:甲____乙(填“>”、“<“或“=”)。
③请写出图中构成原电池的装置正极的电极反应式______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃料电池是目前电池研究的热点之一。某课外小组自制的氢氧燃料电池如图所示,a、b均为惰性电极下列叙述不正确的是( )

A.a极是负极,该电极上发生氧化反应
B.b极发生的电极反应是O2+4OH--4e-=2H2O
C.电池总反应方程式为2H2+O2=2H2O
D.氢氧燃料电池是一种具有应用前景的绿色电源
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com