
【题目】如图所示装置进行探究实验,以验证产物中有乙烯生成且乙烯具有不饱和性。当温度迅速上升后,可观察到试管中溴水褪色,烧瓶中浓硫酸与乙醇的混合液体变为棕黑色。
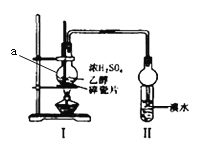
(1)仪器a的名称为____________,II中球形干燥管的作用是_______________,碎瓷片的作用___________;
(2)甲同学认为:考虑到该混合液体反应的复杂性,溴水褪色的现象不能证明反应中有乙烯生成且乙烯具有不饱和性,其理由正确的是______(填字母序号);
A.乙烯与溴水易发生取代反应
B.使溴水褪色的物质,未必是乙烯
C.温度过高导致浓硫酸被还原产生的SO2也会使溴水褪色
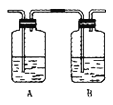
(3)丙同学对上述实验装置进行了改进,在I和II之间增加如图装置,则A中的试剂应为______________,其作用是______________,B中的试剂为______________。
(4)写出该实验中生成乙烯的化学方程式:___________________________
【答案】圆底烧瓶 防止倒吸 防止暴沸 BC NaOH溶液 吸收SO2 品红溶液 CH3CH2OH ![]() CH2=CH2↑+H2O
CH2=CH2↑+H2O
【解析】
(1)根据仪器的结构判断仪器a;乙烯与溴水发生加成反应,会造成烧瓶中气体的压强减小,反应在170℃时发生,液体容易暴沸,据此分析解答;
(2)浓硫酸具有强烈的脱水性和氧化性,能将乙醇脱水生成碳,自身被还原生成二氧化硫,二氧化硫含有还原性;
(3)二氧化硫属于酸性氧化物,能将二氧化硫吸收,二氧化硫能使品红溶液褪色;
(4)在浓硫酸作催化剂、170℃加热条件下,乙醇发生消去反应生成乙烯,据此书写反应的方程式。
(1)根据图示,仪器a为圆底烧瓶;乙烯与溴水发生加成反应,会造成烧瓶中气体的压强减小,II中球形干燥管可以防止倒吸,碎瓷片可以防止液体暴沸,故答案为:圆底烧瓶;防止倒吸;防止暴沸;
(2)浓H2SO4具有强烈的脱水性和氧化性,能将乙醇脱水生成碳,自身被还原生成二氧化硫,C+2H2SO4![]() CO2↑+2SO2↑+2H2O,SO2具有还原性,也可以与Br2发生氧化还原反应生成硫酸和氢硫酸而使溴褪色,反应方程式为SO2+Br2+2H2O=2HBr+H2SO4,所以BC正确,故答案为:BC;
CO2↑+2SO2↑+2H2O,SO2具有还原性,也可以与Br2发生氧化还原反应生成硫酸和氢硫酸而使溴褪色,反应方程式为SO2+Br2+2H2O=2HBr+H2SO4,所以BC正确,故答案为:BC;
(3)二氧化硫能和溴发生氧化还原反应而使溴水褪色,从而干扰乙烯的检验,二氧化硫属于酸性氧化物,能和碱反应生成盐,为防止二氧化硫干扰乙烯的检验,可以用氢氧化钠溶液除去二氧化硫,二氧化硫能使品红溶液褪色,所以可以用品红溶液检验是否存在二氧化硫,实验时要先吸收二氧化硫,再检验二氧化硫是否被除尽,则A中的试剂是NaOH溶液,B中液体是品红溶液,故答案为:NaOH溶液;吸收SO2;品红溶液;
(4)在浓硫酸作催化剂、170℃加热条件下,乙醇发生消去反应生成乙烯,反应方程式为:CH3CH2OH ![]() CH2=CH2↑+H2O,故答案为:CH3CH2OH
CH2=CH2↑+H2O,故答案为:CH3CH2OH ![]() CH2=CH2↑+H2O。
CH2=CH2↑+H2O。


科目:高中化学 来源: 题型:
【题目】如图所示阴阳膜组合电解装置用于循环脱硫,用NaOH溶液在反应池中吸收尾气中的二氧化硫,将得到的Na2SO3溶液进行电解又制得NaOH。其中a、b离子交换膜将电解槽分为三个区域,电极材料为石墨,产品C为H2SO4溶液。下列说法正确的是( )

A. b为只允许阳离子通过的离子交换膜
B. 阴极区中B最初充入稀NaOH溶液,产品E为氧气
C. 反应池采用气、液逆流方式,目的是使反应更充分
D. 阳极的电极反应式为SO32-+2e-+H2O===2H++SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
1 | ① | ||||||
2 | ② | ⑤ | |||||
3 | ③ | ⑥ | |||||
4 | ④ | ⑦ | |||||
(1)表中________(填元素符号)的非金属性最强;________(填元素符号)的金属性最强,写出该元素的单质与水反应的离子方程式:___________________________________________________。
(2)表中元素③的原子结构示意图是____________。
(3)表中元素⑥、⑦的氢化物的稳定性顺序为
(4)表中元素最高价氧化物对应水化物酸性最强的是________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在500 mL KNO3和Cu(NO3)2的混合溶液中,c(NO3-)=6 mol/L,用石墨电极电解此溶液,当通电一段时间后,两极均收集到22.4 L气体(标准状况),假定电解后溶液体积仍为500 mL,下列说法正确的是
A. 电解得到的Cu的物质的量为0.5 mol
B. 向电解后的溶液中加入98 g的Cu(OH)2可恢复为原溶液
C. 原混合溶液中c(K+)=4 mol/L
D. 电解后溶液中c(H+)=2 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关氯水的叙述不正确的是( )
A.新制氯水可使pH试纸先变红,后褪色B.氯水放置数天后,溶液的酸性逐渐减弱
C.新制的氯水只含Cl2、H2O和HClO三种分子D.光照氯水有气泡逸出,该气体是O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W的原子半径是同周期中最小的。下列判断错误的是( )
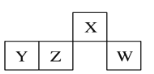
A.原子半径:rY>rZ>rWB.X、Y两元素形成化合物是酸性氧化物
C.最简单气态氢化物的热稳定性:Z>WD.X、Z两元素形成一种化合物可作干燥剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,反应X(g)![]() 4Y(g)+Z(g) ΔH=-Q kJ·mol-1在2 L恒容密闭容器中进行,X和Z的浓度随时间变化如图所示,下列说法不正确的是
4Y(g)+Z(g) ΔH=-Q kJ·mol-1在2 L恒容密闭容器中进行,X和Z的浓度随时间变化如图所示,下列说法不正确的是
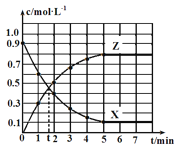
A. 2 min内,X的平均反应速率为0.25 mol·L-1·min-1
B. 第t min时,该反应达到平衡状态
C. 第5 min后,X的生成速率与Z的生成速率相等且保持不变
D. 5 min内,反应放出的热量为1.6Q kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一氢气和氯气的混合气体,经点燃并充分燃烧,然后将气体冷却,并用 200mL 4.00mol·L-1 的 NaOH 溶液恰好完全吸收,测得溶液中含有 ClO-的物质的量为 0.1mol。
(1)所得溶液中 Cl-的物质的量为_________mol;
(2)原混合气体中氢气和氯气的物质的量比为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为除去括号内的杂质,所选用的试剂或方法不正确的是
A. Na2CO3溶液(NaHCO3),选用适量的NaOH溶液
B. NaHCO3溶液(Na2CO3),应通入过量的CO2气体
C. Na2O2粉末(Na2O),将混合物在氧气中加热
D. Na2CO3溶液(Na2SO4),加入适量Ba(OH)2溶液,过滤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com