
【题目】下列有关氯水的叙述不正确的是( )
A.新制氯水可使pH试纸先变红,后褪色B.氯水放置数天后,溶液的酸性逐渐减弱
C.新制的氯水只含Cl2、H2O和HClO三种分子D.光照氯水有气泡逸出,该气体是O2
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:
【题目】已知某无色溶液X可能由K+、Mg2+、Cu2+、Ag+、Ba2+、Al3+、Fe2+、AlO2-、CO32-、SO42-、I-、SiO32-,MnO4-中的N种离子组成。某化学兴趣小组通过下列实验确定了其组成:
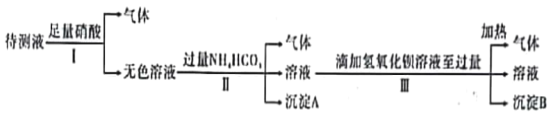
回答下列问题:
(1)不用做实验就可以肯定原溶液X中不存在的离子是_______________(填离子符号)。
(2)通过上述实验知,X溶液中一定存在__________种离子(填数字;不考虑H+、OH-)。
(3)在上述滴加氢氧化钡溶液过程中,开始阶段发生反应的离子方程式一定有_____________
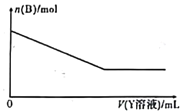
(4)该化学兴趣小组的同学为了进一步确定白色沉淀B的成分,取一定量经洗涤后的B与Y溶液反应,沉淀B的物质的量与Y溶液体积之间的关系如图所示。Y可能为____________。B的组成为__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物K是某药物的前体,合成路线如图所示:
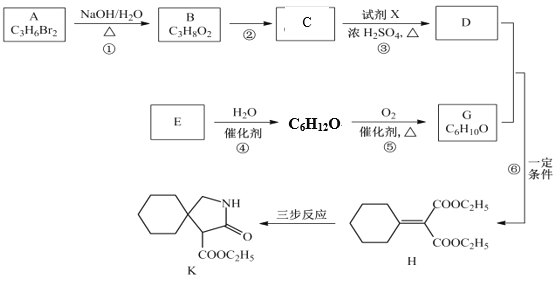
已知:R-CN ![]()
![]() ;
;
![]()
![]() +
+![]()
(1)B的结构简式是_____________。
(2)反应③的化学方程式是__________________。
(3)E属于烃,其分子式是_________________。
(4)H中含氧官能团的名称是_________________。
(5)写出满足下列条件的 K的一种同分异构体的结构简式:________________________
①遇氯化铁溶液显紫色; ②不含醚键; ③核磁共振氢谱显示峰面积之比为2:12:2:2:1
(6)H经三步反应合成K,写出J→K的化学方程式_____________________________。
![]() .
.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中含有大量Na+、C1-及少量Ca2+、Mg2+、SO42-,用电渗析法对该海水样品进行淡化处理,如右图所示。下列说法正确的是

A. b膜是阳离子交换膜
B. A极室产生气泡并伴有少量沉淀生成
C. 淡化工作完成后A、B、C三室中pH大小为pHA<pHB<pHC
D. B极室产生的气体可使湿润的KI淀粉试纸变蓝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知几种化学键的键能和热化学方程式如下:
化学键 | H—N | N—N | Cl—Cl | N | H—Cl |
键能/(kJ·mol-1) | 391 | 193 | 243 | 946 | 432 |
N2H4(g)+2Cl2(g)=N2(g)+4HCl(g) ΔH,下列推断正确的是( )
A.H(g)+Cl(g)=HCl(g) ΔH=+432kJ·mol-1
B.断裂1molCl—Cl键吸收能量比断裂1molN![]() N键多703kJ
N键多703kJ
C.上述反应中,ΔH=-431kJ·mol-1
D.上述反应中,断裂极性键和非极性键,只形成极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置进行探究实验,以验证产物中有乙烯生成且乙烯具有不饱和性。当温度迅速上升后,可观察到试管中溴水褪色,烧瓶中浓硫酸与乙醇的混合液体变为棕黑色。
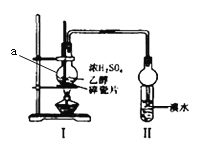
(1)仪器a的名称为____________,II中球形干燥管的作用是_______________,碎瓷片的作用___________;
(2)甲同学认为:考虑到该混合液体反应的复杂性,溴水褪色的现象不能证明反应中有乙烯生成且乙烯具有不饱和性,其理由正确的是______(填字母序号);
A.乙烯与溴水易发生取代反应
B.使溴水褪色的物质,未必是乙烯
C.温度过高导致浓硫酸被还原产生的SO2也会使溴水褪色
(3)丙同学对上述实验装置进行了改进,在I和II之间增加如图装置,则A中的试剂应为______________,其作用是______________,B中的试剂为______________。
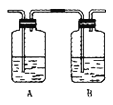
(4)写出该实验中生成乙烯的化学方程式:___________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组为了探究NaClO溶液的性质,设计了下列实验,并记录实验现象。
实验装置 | 实验序号 | 滴管试剂 | 试管试剂 | 实验现象 |
| ① | 0.2 mol/L NaClO溶液 | 饱和Ag2SO4溶液 | 产生白色沉淀 |
② | CH3COOH溶液 | 光照管壁有无色气泡 | ||
③ | 0.2mol/LFeSO4酸性溶液和KSCN溶液 | 溶液变红 | ||
④ | 0.2mol/L的AlCl3溶液 | 产生白色沉淀 |
则以下判断不正确的是
A. 实验①:发生的反应为Ag++ClO-+H2O=AgCl↓+2OH- B. 实验②:无色气体为O2
C. 实验③:还原性强弱顺序Fe2+>Cl- D. 实验④:ClO-与Al3+的水解相互促进
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生产上用过量烧碱溶液处理某矿物(含Al2O3、MgO),过滤后得到滤液用NaHCO3溶液处理,测得溶液pH和Al(OH)3生成的量随加入NaHCO3溶液体积变化的曲线如下:

下列有关说法不正确的是
A. NaHCO3溶液的物质的量浓度为0.8 mol/L
B. b点与c点溶液所含微粒种类相同
C. a点溶液中存在的离子是Na+、AlO2-、OH-、H+
D. 生成沉淀的离子方程式为:HCO3-+AlO2-+H2O === Al(OH)3↓+CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含硫化合物多为重要的化工原料。请回答下列问题:
I.多硫化物是含多硫离子(Sx2-)的化合物,可用作废水处理剂、硫化剂等。
(1)Na2S2的电子式为___。
(2)Na2S5(易溶于水)在酸性条件下可生成H2S和S,该反应的离子方程式为___。
(3)黄铁矿(FeS2)是工业上制硫酸的重要原料,在氧气中煅烧生成Fe2O3和SO2,其煅烧的化学方程式为___。
II.焦亚硫酸钠(Na2S2O5)是一种食品抗氧化剂,易溶于水。
(4)焦亚硫酸钠(Na2S2O5)中硫元素的化合价为___。
(5)向某些饮料中添加少量焦亚硫酸钠(Na2S2O5),可降低饮料中溶解氧的含量,发生反应的离子方程式为__。
(6)向饱和碳酸钠溶液中通入过量SO2可制得焦亚硫酸钠,发生反应的化学方程式为__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com