
【题目】一定温度下,用水吸收SO2气体时,溶液中水的电离平衡________移动(填“向左”“向右”或“不”);若得到pH=4的H2SO3溶液,试计算溶液中![]() =________;SO2可用足量小苏打溶液吸收,反应的离子方程式是_________。(已知该温度下,H2SO3的电离常数:Ka1=4.5×10-2,Ka2=2.5×10-7,H2CO3的电离常数:Ka1=8.4×10-7,Ka2=1.2×10-10)
=________;SO2可用足量小苏打溶液吸收,反应的离子方程式是_________。(已知该温度下,H2SO3的电离常数:Ka1=4.5×10-2,Ka2=2.5×10-7,H2CO3的电离常数:Ka1=8.4×10-7,Ka2=1.2×10-10)
【答案】向左 400 HCO3-+SO2=HSO3-+CO2
【解析】
向水中加入能电离出氢离子或氢氧根离子的物质抑制水的电离;SO2与水反应产生亚硫酸,亚硫酸电离产生H+,根据H2SO3的电离平衡常数分析计算;根据强酸与弱酸盐反应制取弱酸书写反应的离子方程式。
二氧化硫和水反应生成亚硫酸,亚硫酸电离生成氢离子导致溶液中氢离子浓度增大,从而抑制水电离,即水的电离平衡向逆反应方向移动;亚硫酸的电离平衡方程式为H2SO3![]() H++HSO3-,若得到pH=4的H2SO3溶液,c(H+)=10-4 mol/L,由于Ka2=
H++HSO3-,若得到pH=4的H2SO3溶液,c(H+)=10-4 mol/L,由于Ka2= =2.5×10-7,所以
=2.5×10-7,所以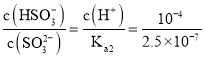 =400;
=400;
由于Ka1(H2SO3)> Ka1(H2CO3)> Ka2(H2SO3),所以SO2通入小苏打溶液,反应产生NaHSO3和CO2,反应的离子方程式是HCO3-+SO2=HSO3-+CO2。


科目:高中化学 来源: 题型:
【题目】已知液氨的性质与水相似。T℃时,NH3+NH3![]() NH4++NH2—,NH4+的平衡浓度为1×10-15 mol·L-1,则下列说法中正确的是
NH4++NH2—,NH4+的平衡浓度为1×10-15 mol·L-1,则下列说法中正确的是
A.在此温度下液氨的离子积为1×10-17
B.在液氨中放入金属钠,可生成NaNH2
C.恒温下,在液氨中加入NH4Cl,可使液氨的离子积减小
D.降温,可使液氨电离平衡逆向移动,且c(NH4+)<c(NH2—)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用 AG 表示溶液酸度:AG=lg![]() 。常温下,用 0.1 mol·L-1 的 NaOH 溶液滴定 25 mL 0.1 mol·L-1 的 CH3COOH。滴定结果可表示如图,下列分析正确的是( )
。常温下,用 0.1 mol·L-1 的 NaOH 溶液滴定 25 mL 0.1 mol·L-1 的 CH3COOH。滴定结果可表示如图,下列分析正确的是( )
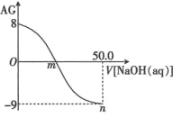
A.常温下 CH3COOH 的 Ka 数量级为 10-6
B.m 点加入 NaOH 的体积为 25 mL
C.n 点:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
D.在滴加 NaOH 溶液的过程中,溶液中 m 点水的电离程度最大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国多条高压直流电线路的瓷绝缘子出现铁帽腐蚀现象,在铁帽上加锌环能有效防止铁帽的腐蚀,防护原理如图所示。下列说法错误的是
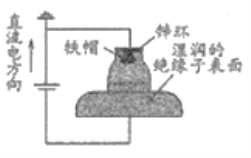
A. 通电时,锌环是阳极,发生氧化反应
B. 通电时,阴极上的电极反应为2H2O+2e-=H2↑+2OH-
C. 断电时,锌环上的电极反应为Zn2++2e-=Zn
D. 断电时,仍能防止铁帽被腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A.标准状况下,等物质的量的C2H4和CH4所含的氢原子数均为4NA
B.1L0.4mol/L亚硫酸钠溶液中H2SO3、HSO3-、SO32-的总数为0.4NA
C.向含4molFeI2的溶液中通入等物质的量的Cl2,转移的电子数为4NA
D.100g98%的硫酸与磷酸的混合溶液中含氧原子数为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】构成原电池的条件有很多,其中一种就是利用电解质的浓度差构成“浓差电池”。当电解质中某离子的浓度越大时其氧化性或还原性越强。如图,甲池为3mol·L-1的AgNO3溶液,乙池为1mol·L-1的AgNO3溶液,A、B均为Ag电极。实验开始先闭合K2,断开K1,发现电流计指针发生偏转。下列说法不正确的是

A. 一段时间后电流计指针将归零,此时可视为反应不再进行
B. 当电流计指针归零后,闭合K1,断开K2后,乙池溶液浓度上升
C. 当电流计指针归零后,闭合K1,断开K2后,乙中Ag电极质量增加
D. 实验开始先闭合K2,断开K1,此时NO3-向B电极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H是合成抗炎药洛索洛芬钠的关键中间体,它的一种合成路线如下:
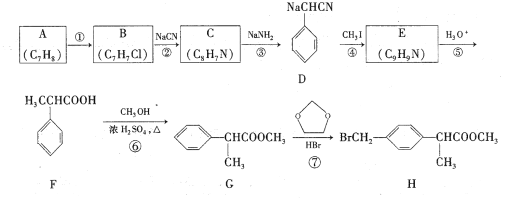
回答下列问题:
(1)A的名称是____,H中官能团名称是____;
(2)反应①的反应条件为____;
(3)反应⑥的化学方程式为________;反应类型为____。
(4)反应⑦除生成H外,还生成了另一种有机产物的结构简式为____。
(5)符合下列条件的G的同分异构体有____种。
I.能发生银镜反应 Ⅱ.苯环上一氯取代物只有一种 Ⅲ.核磁共振氢谱有4组峰
(6)仿照H的合成路线,设计一种由B合成![]() 的合成路线___。
的合成路线___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在常温下,向10mL浓度均为0.1mol·L-1的NaOH和Na2CO3混合溶液中滴0.1mol·L-1的盐酸,溶液pH随盐酸加入体积的变化如图所示。下列说法正确的是
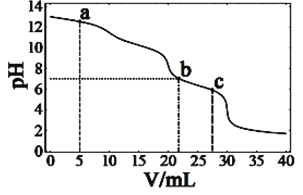
A. 在a点的溶液中,c(Na+)>c(CO32-)>c(Cl-)>c(OH-)>c(H+)
B. 在b点的溶液中,2n(CO32-)+n(HCO3-)<0.001mol
C. 在c点的溶液pH<7,是因为此时HCO3-的电离能力大于其水解能力
D. 若将0.1mol·L-1的盐酸换成同浓度的醋酸,当滴至溶液的pH=7时:c(Na+)=c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验对相应的现象解释不正确的是
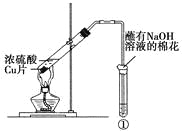
选项 | ①中试剂 | ①中现象 | 解释 |
A | Ba(NO3)2溶液 | 生成白色沉淀 | SO32-与Ba2+生成白色BaSO3沉淀 |
B | 品红溶液 | 溶液褪色 | SO2具有漂白性 |
C | 紫色石蕊溶液 | 溶液变红 | SO2与水反应生成酸 |
D | 酸性KMnO4溶液 | 紫色褪去 | SO2具有还原性 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com