
【题目】金属钛性能优越,被誉为继Fe、Al后应用广泛的“第三金属”"
(1)Ti位于周期表的___________(填“s”“p”“d"或“ds")区,写出基态Ti的外围电子排布式:___________。
(2)月球岩石——玄武岩的主要成分为钛酸亚铁( FeTiO3)。FeTiO3与80%的硫酸反应可生成TiOSO4。其中SO42-的 VSEPR模型为___________。
(3)TiCl2可用作烯烃定向聚合的催化剂,例如丙烯用三乙基铝和三氯化钛作催化剂时,可以发生下列聚合反应:nCH3CH=CH2 ![]() ,该反应中涉及的物质中碳原子的杂化轨道类型有___________:反应中涉及的元素中电负性最大的是___________。
,该反应中涉及的物质中碳原子的杂化轨道类型有___________:反应中涉及的元素中电负性最大的是___________。
(4)羰基铁[Fe(CO)5]可用作催化剂、汽油抗爆剂等。1mol Fe(CO)5分子中含___________molσ键,与CO互为等电子体的离子是___________(填化学式,写一种)。
(5)金属钛有两种同素异形体,常温下是六方堆积,高温下是体心立方堆积。如图所示是钛晶体的一种晶胞,该六棱柱底边边长为c cm,高为a cm,则:

①该晶胞中Ti的配位数为___________。
②该钛晶体的密度为______________________g·cm-3(用NA表示阿伏加德罗常数的值,列出计算式即可)。
【答案】d 3d24s2 正四面体 sp3、sp2 Cl 10 CN-、C22-或NO+ 12 ![]()
【解析】
由Ti的原子序数22可推知所在区及电子排布式,由VSEPR理论计算相应模型及杂化形式,然后用均摊法及密度公式计算出晶胞密度。
(1)Ti的原子序数22,位于第四周期ⅣB族,属于d区,基态Ti的外围电子排布式为3d24s2;
(2)根据价层电子对互斥理论可知,SO42-的中心原子S原子的价电子对数为4、孤对电子对数=(6+2-4×2)÷2=0,所以SO42-的空间构型为正四面体形;
(3)CH3CH=CH2中左边单键碳原子有4个σ键,无孤电子对,为sp3杂化,中间碳原子有3个σ键,无孤电子对,为sp2杂化;同一周期从左至右,电负性逐渐增大,同一主族从上至下,电负性逐渐减小,故负性最大的是Cl;
(4)1个CO分子中有1个σ键,1个CO分子与Fe形成1个配位键,配位键也是σ键,所以1mol Fe(CO)5含10molσ键;与CO互为等电子体的离子有CN-、C22-或NO+;
(5)该结构为六方最密堆积,配位数为12;1个该晶胞中有6个钛原子,由![]() 。
。


科目:高中化学 来源: 题型:
【题目】格列卫是治疗白血病和多种癌症的一种抗癌药物,在其合成过程中的一种中间产物结构表示如下:

下列有关该中间产物的说法不正确的是
A. 分子中可以发生水解反应的官能团有两种
B. 碱性条件下水解的产物之一,含有官能团—NH2
C. 碱性条件下水解的产物之一,经酸化后自身可以发生缩聚反应
D. 水解产物的单个分子中,苯环上都有3种不同化学环境的氢原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种“全氢电池”的工作原理如图所示。下列说法正确的是

A. 电流方向是从吸附层M通过导线到吸附层N
B. 离子交换膜可阻止左边的碱性溶液和右边的酸性溶液发生中和
C. Na+从右边穿过离子交换膜向左边移动
D. 正极的电极反应是H2-2e-+2OH-=2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】蓓萨罗丁是一种治疗顽固性皮肤T细胞淋巴瘤的药物,其结构如图所示。下列有关说法正确的是

A. 分子中所有碳原子在同一平面内
B. 既能发生加成反应,又能发生消去反应
C. 能使溴水、酸性高锰酸钾溶液褪色,且原理相同
D. 1mol蓓萨罗丁分别与足量的Na、 NaHCO3反应,产生气体的物质的量之比为l︰2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将生物质气(主要成分为CO、CO2和H2)甲烷化是改善燃气质量、改善燃气热值的有效手段之一。在催化剂的作用下,某密闭容器中,进行生物质气甲烷化时发生的主要反应为
①CO(g)+3H2(g)![]() CH4(g)+H2O(g) △H1;
CH4(g)+H2O(g) △H1;
②CO2(g)+4H2(g)![]() CH4(g)+2H2O(g) △H2=-165.1kJ·mol-1;
CH4(g)+2H2O(g) △H2=-165.1kJ·mol-1;
③CO(g)+H2O(g)![]() CO2(g)+H2(g) △H3=-41.2kJ·mol-1。
CO2(g)+H2(g) △H3=-41.2kJ·mol-1。
请回答下列问题:
(1)△H1=___________,该反应在___________(填“高温”或“低温”)条件下能够自发进行。
(2)在合成气投料比保持恒定时,体系中的CO平衡转化率(α)与温度和压强的关系如图所示。α(CO)随温度升高而减小的原因是______________________。图中的压强由大到小的顺序为___________。

(3)温度为T1℃,在三个容积均为1L的恒容密闭容器中仅发生反应CO(g)+3H2(g)![]() CH4(g)+H2O(g),该反应中,正反应速率为v正=k正c(CO)c3(H2),逆反应速率为v逆=k逆c(CH4)·c(H2O),k正、k逆为速率常数,受温度影响。在第I个容器中,3min反应达到平衡时,CH4与CO的体积分数相同,则氢气的速率v(H2)=___________;下列说法正确的是___________(填序号)。
CH4(g)+H2O(g),该反应中,正反应速率为v正=k正c(CO)c3(H2),逆反应速率为v逆=k逆c(CH4)·c(H2O),k正、k逆为速率常数,受温度影响。在第I个容器中,3min反应达到平衡时,CH4与CO的体积分数相同,则氢气的速率v(H2)=___________;下列说法正确的是___________(填序号)。

A.当温度改变为T2时,若k正=1.5k逆,则T2>T1
B.达平衡时,容器Ⅱ中H2的体积分数小于25%
C.达平衡时,容器Ⅲ与容器I中的总压强之比小于19︰20
D.达平衡时,容器Ⅱ中α(CO)大于容器I中α(CO)
(4)甲烷可作燃料电池的原料,若电解质为盐酸,当外电路转移16mol电子时(不考虑电子的损失),将负极产生的气体全部通入到2L1.5mol/L的NaOH溶液中充分反应,则溶液中所有离子的物质的量浓度由大到小的顺序是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学设计了如图所示的实验装置来进行实验探究:
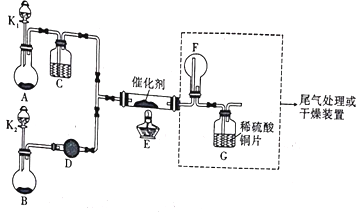
I.氨的催化氧化(4NH3+5O2 ![]() 4NO+6H2O):
4NO+6H2O):
(1)A中加入的是一种黑色的固体,B装置是制备___________的装置,D中装的试剂为___________。
(2)甲、乙同学分别按图示装置进行实验,一段时间后,装置G中的溶液都变成蓝色,甲观察到装置F中有红棕色气体,乙观察到装置F中有白烟生成。G中溶液变蓝的原因是(用离子方程式表示)______________________,白烟的成分为___________。甲、乙两同学分析了F装置现象不同的原因,乙同学通过改变实验操作:______________________,也在F中看到了红棕色气体生成。
Ⅱ.测定SO2转化为SO3的转化率:
已知:SO3的熔点是16.8℃,沸点是44.8℃。
(3)根据实验需要,应将F、G处替换成图中的装置(填序号)F.___________G._________。
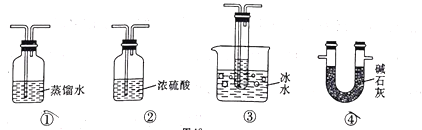
(4)在A中加入 a mol Na2SO3粉末与足量浓硫酸反应,当反应结束时,让B装置继续再反应一段时间,最后测得G处装置增重bg,则此时SO2的转化率为___________(用含a、b的代数式表示)。
(5)丙同学观察整套装置后,推断该实验结果必定偏高,他更换了一个三孔橡皮塞,改动装置后重新实验,获得了更符合实际的转化率。请推断他对装置的改动是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图为元素在生物体内的含量分布情况,下列表述错误的是
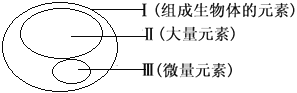
A. P、S、K、Ca、Zn属于大量元素
B. 在非生物界中都能找到,体现生物界与非生物界的统一性
C. Ⅱ和Ⅲ为生物体的必需元素,一旦缺乏就可能会导致相应的病症
D. Ⅲ含量虽少,却是生物体正常生命活动不可缺少的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化工小组研究银铜复合废料(表面变黑,生成Ag2S)回收银单质及制备硫酸铜晶体,工艺如下 :(废料中的其他金属含量较低,对实验影响可忽略)

已知:① AgCl可溶于氨水,生成[Ag(NH3)2]+;
② Ksp(Ag2SO4)=1.2×10-5,Ksp(AgCl)=1.8×10-10;
③渣料中含有少量银和硫酸银(微溶)。
(1)操作I中为了加快空气熔炼速率,可以采取____________措施(写出其中一种即可)。
(2)操作IV经过_______________、_________________、过滤、洗涤和干燥,可以得到硫酸铜晶体。
(3)洗涤滤渣II,与粗银合并,目的是________________________________。
(4)操作III中,NaClO溶液与Ag反应的产物为AgCl、NaOH、NaCl和O2,该反应的化学方程式为_________________________________(其中AgCl和NaCl的物质的量之比为2:1)。氧化的同时发生沉淀转化,离子方程式为______________________________,其平衡常数K=_____________________。 HNO3也能氧化Ag,从反应产物的角度分析,以HNO3代替NaClO的缺点是_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com