
【题目】下列说法不正确的是
A.乙烯的官能团是碳碳双键
B.75%的乙醇溶液可以杀菌消毒
C.乙酸的酸性比碳酸弱
D.酯化反应是可逆反应
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】将6.5 g锌放入足量的稀硫酸中充分反应,得到80 mL密度为1.25 g/mL的溶液。试计算回答:
①所得溶液中硫酸锌的物质的量浓度为________,质量分数为____。
②生成的气体在标准状况下的体积为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂离子电池应用十分广泛,从废旧钻酸锂(LiCoO2)锂离子电池中回收铝、铁、钴、锂等元素成了重要的研究课题。现欲利用图19所示的工艺流程回收废旧电池中的某些金属资源(部分条件未给出)。回答下列问题:

已知:①滤液1中阳离子有H+、Co2+、Fe2+、Al3+、Li+等;
②两种物质不同温度下的溶解度如下表所示:

(1)钴酸锂( LiCoO2)钴元素的化合价为___________。
(2)浸泡时加入Na2SO3的主要目的是______________________;可用盐酸代替H2SO4和Na2SO3的混合液,但缺点是______________________。
(3)滤液1中加入NaClO3的主要目的是______________________(用离子方程式表示)。
(4)为了使Fe3+、Al3+沉淀完全(通常认为金属离子浓度小于或等于10-5mo·L-1时已沉淀完全)加入氨水调节pH的最小值是___________。(已知:Ksp[Fe(OH)3]=1.0×10-39,Ksp[Al(OH)3]=2.7×10-34,1g3=0.52)
(5)滤液3中加入饱和Na2CO3溶液,过滤后,需要用“热水洗涤”的原因是___________。
(6)利用LiOH和钴氧化物可制备锂离子电池正极材料。LiOH可由电解法制备,利用如图所示的装置电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液。B极区电解液为___________(填化学式)溶液;阳极电极反应式为______________________;电解过程中Li+向___________(填“A”或“B”)电极迁移。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钛性能优越,被誉为继Fe、Al后应用广泛的“第三金属”"
(1)Ti位于周期表的___________(填“s”“p”“d"或“ds")区,写出基态Ti的外围电子排布式:___________。
(2)月球岩石——玄武岩的主要成分为钛酸亚铁( FeTiO3)。FeTiO3与80%的硫酸反应可生成TiOSO4。其中SO42-的 VSEPR模型为___________。
(3)TiCl2可用作烯烃定向聚合的催化剂,例如丙烯用三乙基铝和三氯化钛作催化剂时,可以发生下列聚合反应:nCH3CH=CH2 ![]() ,该反应中涉及的物质中碳原子的杂化轨道类型有___________:反应中涉及的元素中电负性最大的是___________。
,该反应中涉及的物质中碳原子的杂化轨道类型有___________:反应中涉及的元素中电负性最大的是___________。
(4)羰基铁[Fe(CO)5]可用作催化剂、汽油抗爆剂等。1mol Fe(CO)5分子中含___________molσ键,与CO互为等电子体的离子是___________(填化学式,写一种)。
(5)金属钛有两种同素异形体,常温下是六方堆积,高温下是体心立方堆积。如图所示是钛晶体的一种晶胞,该六棱柱底边边长为c cm,高为a cm,则:

①该晶胞中Ti的配位数为___________。
②该钛晶体的密度为______________________g·cm-3(用NA表示阿伏加德罗常数的值,列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有甲、乙、丙三种溶液,进行如下操作
![]()
则甲、乙、丙三种溶液中溶质可能是
A.BaCl2、H2SO4、MgCl2 B.CaCl2、HNO3、AgNO3
C.CaCl2、HNO3、NaCl D.BaCl2、HCl、NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国早期科技丛书《物理小识·金石类》写到:“青矾厂气熏人,衣服当之易烂,载木不盛,惟乌柏树不畏其气”,“青矾”则是绿矾,强热时发生如下反应:
2FeSO4·7H2O→Fe2O3+SO3+SO2+7H2O
回答下列问题:
(1)基态硫原子的价层电子排布式___________,其最高能级上电子云形状是___________,上述四种元素电负性由大到小的顺序是___________,从结构的角度解释Fe3+稳定性强于Fe2+的原因是__________。
(2)氧、硫能形成许多化合物,如:H2O、SO2、SO3、SO42-,这些物质的中心原子杂化轨道类型为SP2的是___________,空间构型是V形的分子是___________,属于非极性分子的是___________。
(3)已知Fe2O3熔点为1565℃,在熔化状态下液体中存在两种粒子,则其晶体类型最可能是___________,若FeO与Fe2O3晶体类型相同,则二者熔点较高的物质是___________。
(4)铁的某种氧化物晶胞如图所示(实心球为铁原子);
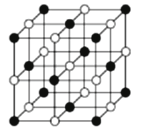
①该氧化物的化学式为___________。
②氧、铁的原子半径分别为rO pm、rFe pm,晶体密度为ρg·cm-3,阿伏伽德罗常数的值为NA,该晶胞的空间利用率为___________(用含π的式子表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列式子属于水解反应,且溶液呈酸性的是 ( )
A. HCO3- + H2O ![]() H3O+ + CO32- B. Fe3+ + 3H2O
H3O+ + CO32- B. Fe3+ + 3H2O ![]() Fe(OH)3 + 3H+
Fe(OH)3 + 3H+
C. HS- + H2O ![]() H2S + OH- D. NH4+ + OH-
H2S + OH- D. NH4+ + OH- ![]() NH3↑+ H2O
NH3↑+ H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com